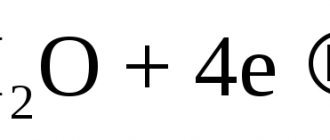Скорость коррозии – многофакторный параметр, который зависит как от внешних условий среды, так и от внутренних свойств материала. В нормативно-технической документации существуют определенные ограничения по допустимым значениям разрушения металла при эксплуатации оборудования и строительных конструкций для обеспечения их безаварийной работы. В проектировании не существует универсального метода определения скорости коррозии. Это связано со сложностью учета всех факторов. Наиболее надежным методом является изучение истории эксплуатации объекта.
Критерии
Вам будет интересно:Процессы изобарный, изохорный, изотермический и адиабатный для идеального газа
В настоящее время в проектировании техники используют несколько показателей скорости коррозии:
- По прямому способу оценки: уменьшение массы металлической детали на единицу поверхности – весовой показатель (измеряется в граммах на 1 м2 за 1 час); глубина повреждений (или проницаемость коррозионного процесса), мм/год; количество выделяющейся газовой фазы продуктов коррозии; продолжительность времени, в течение которого появляется первое коррозионное повреждение; число центров коррозии на единицу площади поверхности, появившихся за определенный срок.
- По косвенной оценке: сила тока электрохимической коррозии; электрическое сопротивление; изменение физико-механических характеристик.
Вам будет интересно:Такие обычные люди, или значение «почему бы и нет»
Первый показатель по прямому методу оценки является наиболее распространенным.
Скорость коррозии металла
В случае равномерной коррозии скорость может быть определена по формуле:
v=Δm / S•t, где
- v — скорость коррозии, которую обычно выражают в таких единицах: г/(м2•ч) или мг/(см2•сут);
- Δm — убыль (увеличение) массы;
- S — площадь поверхности;
- t — время;
Отметим, что весовой показатель не всегда удобен, особенно если сравнивается коррозия металлов разной плотности. В таких случаях лучше пользоваться глубинным показателем коррозии, т.е. средней глубиной проникновения коррозионного разрушения в металл.
Кроме скорости коррозии металла, к часто используемым показателям (критериям) коррозии относят:
Прямые показатели коррозии
- убыль или увеличение массы, отнесенные к единице поверхности металла;
- глубина коррозии;
- доля поверхности, занятая продуктами коррозии;
- количество коррозионных язв или точек (очагов коррозии) на единице поверхности;
- объем выделившегося с единицы поверхности водорода или поглощенного кислорода;
- время до появления первого очага коррозии;
- время до появления коррозионной трещины или полного разрушения образца;
- сила тока коррозии;
Косвенные показатели коррозии
- изменение физико-механических свойств металла (предела прочности при испытаниях на сжатие и разрыв, относительного удлинения, отражательной способности и др.);
- изменение сопротивления;
Расчетные формулы
В общем случае весовые потери, определяющие скорость коррозии металла, находят по следующей формуле:
Vkp=q/(St),
где q – уменьшение массы металла, г;
S – площадь поверхности, с которой произошел перенос материала, м2;
t – период времени, ч.
Для листового проката и изготовленных из него обечаек определяют глубинный показатель (мм/год):
H=m/t,
m – глубина проникновения коррозии в металл.
Между первым и вторым показателями, описанными выше, существует следующая зависимость:
H=8,76Vkp/ρ,
где ρ – плотность материала.
Лабораторная работа №1. Коррозия металлов.
Цель работы:
Изучить влияние изменения условий на протекание коррозии.
Теоретическое введение
Коррозией металлов называют разрушение металлических материалов вследствие химического или электрохимического взаимодействия их с внешней средой. Пример электрохимической коррозии: коррозия металлов в атмосфере при конденсации влаги на металлической поверхности (около 80% металлических конструкций эксплуатируются в атмосферных условиях — транспорт, оборудование заводов, мосты, рельсы и т.д.), коррозия различных трубопроводов в грунте, коррозия металлов в морской и речной воде и т.д.
Основные факторы, влияющие на скорость коррозии
Вам будет интересно:Шуточные номинации для учителей на выпускной
На скорость разрушения металла влияют следующие группы факторов:
- внутренние, связанные с физико-химической природой материала (фазовая структура, химический состав, шероховатость поверхности детали, остаточные и рабочие напряжения в материале и другие);
- внешние (окружающие условия, скорость движения коррозионно-активной среды, температура, состав атмосферы, наличие ингибиторов или стимуляторов и другие);
- механические (развитие коррозионных трещин, разрушение металла под действием циклических нагрузок, кавитационная и фреттинг-коррозия);
- конструктивные особенности (выбор марки металла, наличие зазоров между деталями, требования к шероховатости).
Физико-химические свойства
Наибольшее значение среди внутренних факторов коррозии имеют следующие:
- Термодинамическая устойчивость. Для ее определения в водных растворах применяют справочные диаграммы Пурбе, по оси абсцисс которых откладывается pH среды, а по оси ординат – окислительно-восстановительный потенциал. Сдвиг потенциала в положительную сторону означает большую устойчивость материала. Ориентировочно она определяется как нормальный равновесный потенциал металла. В реальности материалы корродируют с различной скоростью.
- Положение атома в периодической таблице химических элементов. Металлы, наиболее подверженные коррозии, – это щелочные и щелочноземельные. Скорость коррозии снижается при увеличении атомного номера.
- Кристаллическая структура. Она оказывает неоднозначное влияние на разрушение. Крупнозернистая структура сама по себе не приводит к росту коррозии, но благоприятна для развития межкристаллитного избирательного разрушения границ зерна. Металлы и сплавы с однородным распределением фаз корродируют равномерно, а с неоднородным – по очаговому механизму. Взаимное расположение фаз выполняет функцию анода и катода в агрессивной среде.
- Энергетическая неоднородность атомов в кристаллической решетке. Атомы с наибольшей энергией расположены в углах граней микронеровностей и являются активными центрами растворения при химической коррозии. Поэтому тщательная механическая обработка металлических деталей (шлифовка, полировка, доводка) повышает коррозионностойкость. Данный эффект объясняется также формированием более плотных и сплошных оксидных пленок на гладких поверхностях.
Влияние кислотности среды
Вам будет интересно:Копать или капать? Как правильно написать?
В процессе химической коррозии концентрация ионов водорода оказывает влияние на следующие моменты:
- растворимость продуктов коррозии;
- формирование защитных оксидных пленок;
- скорость разрушения металла.
При рН в интервале значений 4-10 единиц (кислый раствор) коррозия железа зависит от интенсивности проникновения кислорода к поверхности объекта. В щелочных растворах скорость коррозии сначала уменьшается из-за пассивации поверхности, а затем, при рН>13 увеличивается в результате растворения защитной оксидной пленки.
Для каждого вида металла существует своя зависимость интенсивности разрушения от кислотности раствора. Благородные металлы (Pt, Ag, Au) устойчивы к коррозии в кислой среде. Zn, Al быстро разрушаются как в кислотах, так и в щелочах. Ni и Cd устойчивы к щелочам, но легко корродируют в кислотах.
Показатели коррозии. Способы выражения скорости коррозии
Для количественной оценки скорости коррозии используют нижеследую-щие показатели.
Массометрический показатель скорости коррозии. Он определяется как отношение убыли массы металла в результате коррозии к его поверхности и времени испытания:
Кm = (mo –m) / S×t
, (1.1)
где mo
,
m
– соответственно масса образца до и после испытания;
S
– площадь поверхности образца;
t
– время испытания.
Данный показатель используется при оценке равномерной коррозии. Он непригоден для оценки неравномерной коррозии, межкристаллитной коррозии.
Объемный показатель коррозии. Он определяется отношением объема выделенного или поглощенного газа в процессе коррозии к поверхности образца и времени испытания:
Кv = V / S×t
, (1.2)
где V
– объем поглощенного или выделенного газа.
Переход металла в продукты коррозии в кислых средах сопровождается выделением эквивалентного количества водорода. В нейтральных кислородосодержащих средах при образовании продуктов коррозии поглощается эквивалентное количество кислорода.
Глубинный показатель скорости. Он определяется как отношение глубины, образовавшейся в результате коррозии каверны, к времени испытания:
Кl = l/t
, (1.3)
где l
– глубина каверны.
Сопоставление этого показателя с массометрическим позволяет оценить степень неравномерности коррозии.
Механический показатель коррозии. Он характеризует изменение механических свойств металла в % за время испытаний. Например, показатель изменения предела прочности
Кg = Gв1 / Gв
, (1.4)
где Gв1, Gв
– соответственно предел прочности металла до и после испытаний.
Токовый показатель коррозии. С его помощью оценивается количество прокорродировавшего металла по известной силе коррозионного тока:
Ка = I×A×t / (F×S),
(1.5)
где I
– ток коррозии;
F
– константа Фарадея;
А
– атомная масса металла;
n
– валентность металла в данном коррозионном процессе.
В соответствии с ГОСТ 13819-68 коррозионную стойкость металлов (стойкость их сопротивляться коррозионному воздействию среды) рекомендуется определять в зависимости от скорости коррозии, которая оценивается по десятибалльной шкале (табл. 1.3).
Таблица 1.3
Десятибалльная шкала коррозионной стойкости металлов
| Группа стойкости | Скорость коррозии металла, мм/год | Балл |
| Совершенно стойкие | Менее 0,001 | |
| Весьма стойкие | Свыше 0,001 до 0,05 Свыше 0,005 до 0,01 | |
| Стойкие | Свыше 0,01 до 0,05 Свыше 0,05 до 0,1 | |
| Пониженно-стойкие | Свыше 0,1 до 0,5 Свыше 0,5 до 1,0 | |
| Малостойкие | Свыше 1,0 до 5,0 Свыше 5 до 10,0 | |
| Нестойкие | Свыше 10 |
Под скоростью коррозии в десятибалльной шкале понимают проникновение коррозии в глубину металла, которая рассчитывается по потере массы после удаления продуктов коррозии:
П = DМ / r×t
, (1.6)
где DМ
– убыль массы металла;
r
— плотность металла.
Коррозионную стойкость металлов при скорости коррозии 0,5 мм/год и выше оценивают по группам стойкости при скорости коррозии ниже 0,5 мм/год по баллам.
Периодичность оценки скорости коррозии оборудования рекомендуется следующая:
при скорости коррозии более 0,1 мм/год – 1,5…2 мес.;
при скорости коррозии менее 0,1 мм/год – 12 мес.
Следует отметить, что приведенная ниже шкала оценки коррозионной стойкости получила достаточно широкое распространение, однако она не универсальна в силу того, что понятие стойкости относительно и связано с назначением оборудования и свойствами коррозионной среды. В качестве примера в табл. 1.4 приведены данные о скорости коррозии стали нефтяного оборудования при контакте с типичной для него коррозионной средой.
Таблица 1.4
Скорость коррозии стали в двухфазной среде 0,5 н. раствор NaCl -углеводород
| Углеводород | Скорость коррозии, г×(м2×ч) | Углеводород | Скорость коррозии, г×(м2×ч) | ||
| без Н2S | 800 мг/л Н2S | без Н2S | 800 мг/л Н2S | ||
| 0,5 н. раствор NaCl Гексан Бензол Циклогексан | 3,0 2,4 2,6 2,1 | 4,5 4,6 4,9 4,3 | Октан Этилбензол Гексадекан Додекан | 2,2 2,7 1,5 0,5 | 4,7 4,8 3,5 — |
2. Взаимодействие между частицами веществ*
Виды взаимодействий
При сближении молекул появляется притяжение, что обусловливает их взаимодействие. К основным видам взаимодействия молекул относятся ван-дер-ваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
Ван-дер-ваальсовы силы включают в себя три составляющие: диполь-дипольное, индукционное и дисперсное взаимодействие (рис. 2.1).
Рис. 2.1. Ван-дер-ваальсовы взаимодействия
молекул:
а
– диполь-дипольное (ориентационное);
б
— индукционное;
в
– дисперсионное
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя. Возникающее взаимодействие называется диполь-дипольным. Энергия этого взаимодействия пропорциональна электрическому моменту диполя и обратно пропорциональна расстоянию между центрами диполей.
Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи. Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя и обратно пропорциональна расстоянию между центрами молекул.
Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия.
В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые, в свою очередь, индуцируют мгновенные диполи у соседних молекул. Их появление и распад происходят синхронно. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Суммарная энергия ван-дер-ваальсовского взаимодействия молекул на 1-2 порядка ниже энергии химических связей.
Водородная связь
Химическая связь, образованная положительно поляризованным водородом молекулы А (или полярной группы) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью. Образование водородной связи обусловлено тем , что в полярных молекулах А (или полярных группах) поляризованный атом водорода обладает уникальными свойствами (отсутствием внутренних оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером), поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Энергия водородной связи возрастает с увеличением электро-отрицательности и уменьшением размеров атомов В, поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N.
В жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления, теплот плавления и парообразования.
Энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и ван-дер-ваальсовых сил.
Состав и концентрация нейтральных растворов
Скорость коррозии в нейтральных растворах зависит в большей степени от свойств соли и ее концентрации:
- При гидролизе солей в коррозионной среде образуются ионы, которые действуют как активаторы или замедлители (ингибиторы) разрушения металла.
- Те соединения, которые увеличивают pH, повышают также скорость деструктивного процесса (например, кальцинированная сода), а те, которые снижают кислотность, – уменьшают ее (хлористый аммоний).
- При наличии хлоридов и сульфатов в растворе разрушение активизируется до достижения некоторой концентрации солей (что объясняется усилением анодного процесса под влиянием ионов хлора и серы), а затем постепенно снижается из-за уменьшения растворимости кислорода.
Некоторые виды солей способны образовывать труднорастворимую пленку (например, фосфорнокислое железо). Это способствует защите металла от дальнейшего разрушения. Данное свойство используется при применении нейтрализаторов ржавчины.
Объемный показатель коррозии
VГ
Kv = ————,см3/м2 ч,(15.2)
τ S
где VГ — объем поглощенного или выделившегося с поверхности металла газа за время коррозии, см3.
Весовой показатель коррозии связан с объемным показателем коррозииследующим уравнением:
Km VМэ (Г)
Kv = ——————,см3/м2 ч,(15.3)
Мэ(Ме)
где Мэ(Ме) – молярная масса эквивалента металла, для железа равна 28г/моль;
VМэ(Г) – объем молярной массы эквивалента поглощенного или выделившегося газа, см3/моль.
Токовый показатель коррозии
Km F B 1000
iкор. = ———————,мА/м2,(15.4)
MMe
где В – валентность корродирующего металла;
F — постоянная Фарадея, равная 26,8 А ч/моль;
MMe — молярная масса атомов металла, г/моль.
Глубинный показатель коррозии
Кm 8,76
П = ——————,мм/год,(15.5)
ρ
где ρ — плотность корродируемого металла, г/см3.
По величине глубинного показателя коррозии П можно определить группу коррозионной стойкости исследуемого образца стали.
Таблица 15.1
Классификация металлов по коррозионной стойкости
(ГОСТ – 13819-66)
| № п/п | Группа стойкости | Скорость коррозии, мм/год | Балл |
| Совершенно стойкие Весьма стойкие Стойкие Пониженно стойкие Мало стойкие Нестойкое | менее 0,001 от 0,001 до 0,005 от 0,005 до 0,01 от 0,01 до 0,05 от 0,05 до 0,1 от 0,1 до 0,5 от 0,5 до 1,0 от 1,0 до 5,0 от 5,0 до 10,0 свыше 10,0 |
Во всех случаях отрицательный весовой показатель необходимо брать в
г/м2 ч.
Знание механизмов различных типов коррозии и мер борьбы с ней является непреложным атрибутом инженера любой специальности. Коррозия приводит не только к потере металла, но и ухудшает его важнейшие технические свойства: прочность, пластичность, электропроводность и др. В результате происходит аварийное разрушение деталей машин и механизмов. Для сельскохозяйственных машин и механизмов характерно сильное взаимодействие металла с агрессивной средой: растворы удобрений и других веществ, сок растений, выделение продуктов жизнедеятельности животных и др.
Поэтому ущерб, наносимый сельскохозяйственной технике и механизмам, особенно велик. Сельское хозяйство занимает 4 место среди всех отраслей народного хозяйства по экономическим потерям в результате коррозии металлов.
Химической коррозии подвергаются детали двигателей внутреннего сгорания, отопительных и нагревательных систем и т.п.
Цель работы
1. Закрепить теоретический материал по данной теме.
2. Сформировать четкое представление о процессах, происходящих при электрохимической коррозии, и методах защиты от нее.
3. Определить коррозионную устойчивость стали и ее покрытий.
Опыт 1. Влияние контакта металлов на скорость коррозионного процесса.
Выполнение опыта
Налить в пробирку до ½ ее объема 1н. раствора соляной кислоты и опустить в нее гранулированный цинк.
Затем опустить в эту же пробирку, зачищенную наждачной бумагой, медную проволоку и привести ее в контакт с цинком.
Наблюдения и выводы
1.Наблюдать выделение пузырьков газа с поверхности цинка, и по интенсивности выделения газа, сделать заключение о скорости реакции (медленно, быстро).
2.Отметить, как влияет контакт металлов на скорость реакции. На каком из металлов при контакте выделяются пузырьки газа?
3. Какой металл является катодным участком и какой – анодным в образовавшейся гальванической паре?
4. Написать электрохимическую схему возникшего коррозионного гальванического элемента и уравнения катодного и анодного процессов.
Опыт 2. Влияние стимулятора и ингибитора на скорость разрушения алюминия
Ингибиторы – это вещества, которые при введении их в коррозионную среду в незначительном количестве заметно снижают скорость электрохимической коррозии металла или сплава. По механизму тормозящего действия ингибиторы подразделяются на анодные и катодные. Используемый в опыте ингибитор уротропин относится к катодным ингибиторам. Ингибиторы такого вида, адсорбируясь на катодных участках поверхности корродирующего металла, повышают перенапряжение водорода, выделяющегося при коррозии.
Выполнение опыта
Налить в три пробирки до ½ их объема 0,5н. раствора сульфата меди CuSO4. Слегка подкислить растворы, прилив одинаковое количество (см. по уровню растворов в пробирках) 0,2н. раствора серной кислоты H2SO4. Первую пробирку оставить контрольной, во вторую — микрошпателем добавить немного кристаллов хлорида натрия NaCl, а в третью – внести кристаллы уротропина и слегка взболтать растворы.
Одновременно в три пробирки поместить алюминиевые проволоки.
Наблюдения и выводы
Об интенсивности разрушения алюминия наблюдать по величине слоя меди, выделившейся на алюминиевой проволоке, и количеству выделяющихся пузырьков газа.
1.Отметить: в какой из пробирок ускоряется течение реакции и в какой -замедляется.
Сделать вывод: что является активатором, а что – ингибитором коррозии?
2.Написать уравнения реакций, отражающих работу образовавшегося коррозионного гальванического элемента:
| 3CuSO4 + 2Al = Al2(SO4)3 + 3Cu (–) Al | H2SO4 | Cu (+) | Al – 3e– = Al3+ |
| Cu2+ + 2e– = Cu |
Опыт 3. Защита от коррозии с помощью металлических покрытий (анодное и катодное)
Выполнение опыта
Проделать реакцию, которая является качественной и позволяет определить в растворе ионы железа Fe2+ . Налить в пробирку 10 – 20 капель 0,1н. раствора соли двухвалентного железа (FeCl2 или FeSO4) и добавить одну каплю 0,1н. раствора гексацианоферрата (III) калия (K3[Fe(CN)6] – красная кровяная соль). Наблюдать окрашивание раствора в синий цвет, вследствие образования комплексной соли Fe3[Fe(CN)6]2.
Налить в две пробирки до 1/3 их объема 0,2н. раствора серной кислоты и добавить по 1 капле 0.1н. раствора гексацианоферрата (III) калия K3[Fe(CN)6]. В одну пробирку опустить кусочек оцинкованного железа, в другую – луженого (покрытого оловом).
Наблюдения и выводы
1. В какой пробирке наблюдается синее окрашивание на границе металл-раствор?
2. Какой металл окисляется (коррозирует) в каждой пробирке?
3. Написать электрохимические схемы, образовавшихся при коррозии гальванических элементов, и уравнения катодного и анодного процессов для рассматриваемых схем.
4. Отметить: какое покрытие является катодным, какое — анодным?
Опыт 4. Электрохимическая защита металлов от коррозии
Выполнение опыта
Налить в пробирку до 1/3 её объема 0,2н. раствора серной кислоты и добавить 1 каплю 0,1н. раствора гексацианоферрата (III) калия K3[Fe(CN)6]. Опустить в пробирку кусочек луженого железа и, защищенную наждачной бумагой, алюминиевую проволоку, приведя их в контакт.
Наблюдения и выводы
1.Объяснить, почему в этом опыте не происходит окрашивания на границе металл-раствор?
2.Какой металл окисляется (коррозирует) и почему?
3.Как называется данный метод защиты?
4.Составить электрохимическую схему, образовавшегося коррозионного гальванического элемента, и записать для него электродные процессы.
Опыт 5. Определение коррозионной устойчивости стали и её покрытий (анодное и катодное)
Выполнение опыта
Для испытания применяется капельный метод Г.В.Акимова.
Каплю раствора, содержащего 40 мл 0,4М раствора сульфата меди CuSO4, 20 мл 10%-ного раствора NaCl и 0,8 мл 0,1М раствора соляной кислоты HCl, нанести на поверхности: стали, оцинкованного и луженого железа (можно оценивать разные марки стали, различные покрытия: металлические, химические).
Отметить время доизменения цвета капли отсине-голубого до красного (или черного).Продолжительность времени в минутах, между моментом нанесения капли и изменением её цвета, служит характеристикой коррозионной стойкости металла и покрытия. Время – 5 минут – является показателем хорошей коррозионной устойчивости.
Опыт повторить 2 –3 раза.
Наблюдения и выводы
1.Результаты испытаний занести в таблицу 15.2.
Таблица 15.2
| Исследуемая поверхность | Время, мин. | Среднее значение, мин. |
| Сталь | ||
| Оцинкованное железо | ||
| Луженое железо |
2. Сделать вывод о коррозионной устойчивости металла и его покрытий.
3. Какое покрытие более устойчиво к коррозии?
ЛАБОРАТОРНАЯ РАБОТА №16
Замедлители коррозии
Замедлители (или ингибиторы) коррозии различаются по механизму действия на окислительно-восстановительный процесс:
- Анодные. Благодаря им образуется пассивная пленка. К данной группе относятся соединения на основе хроматов и бихроматов, нитратов и нитритов. Последний тип ингибиторов применяется для межоперационной защиты деталей. При использовании анодных замедлителей коррозии необходимо предварительно определить их минимальную защитную концентрацию, так как добавление в небольших количествах может привести к увеличению скорости разрушения.
- Катодные. Механизм их действия основан на снижении концентрации кислорода и соответственно, замедлении катодного процесса.
- Экранирующие. Данные ингибиторы изолируют поверхность металла с помощью образования нерастворимых соединений, отлагающихся в виде защитного слоя.
К последней группе относятся нейтрализаторы ржавчины, которые используются также для очистки от окислов. В их состав, как правило, входит ортофосфорная кислота. Под ее влиянием происходит фосфатирование металла – образование прочного защитного слоя нерастворимых фосфатов. Нейтрализаторы наносят пульверизатором или валиком. Через 25-30 минут поверхность приобретает бело-серый цвет. После высыхания состава наносят лакокрасочные материалы.
Механическое воздействие
Повышению коррозии в агрессивной среде способствуют такие типы механического воздействия, как:
- Внутренние (при формовании или термообработке) и внешние (под воздействием приложенной извне нагрузки) напряжения. В результате возникает электрохимическая неоднородность, происходит снижение термодинамической устойчивости материала и формируется коррозионное растрескивание. Особенно быстро происходит разрушение при растягивающих нагрузках (трещины образуются в перпендикулярных плоскостях) в присутствии анионов окислителей, например, NaCl. Типичным примером устройств, подверженных такому типу разрушения, являются детали паровых котлов.
- Знакопеременное динамическое воздействие, вибрации (коррозионная усталость). Происходит интенсивное снижение предела усталости, образуются множественные микротрещины, которые затем сливаются в одну крупную. Число циклов до разрушения в большей степени зависит от химического и фазового состава металлов и сплавов. Такой коррозии подвержены оси насосов, рессоры, лопатки турбин и другие элементы оборудования.
- Трение деталей. Быстрое корродирование обусловлено механическим износом защитных пленок на поверхности детали и химическим взаимодействием со средой. В жидкости скорость разрушения ниже, чем на воздухе.
- Кавитационное ударное воздействие. Кавитация возникает при нарушении сплошности потока жидкости в результате образования вакуумных пузырей, которые схлопываются и создают пульсирующее воздействие. В результате возникают глубокие повреждения локального характера. Данный тип коррозии часто наблюдается в химических аппаратах.
Конструктивные факторы
При конструировании элементов, работающих в агрессивных условиях, необходимо учитывать, что скорость коррозии возрастает в следующих случаях:
- при контакте разнородных металлов (чем больше разница электродного потенциала между ними, тем выше сила тока электрохимического процесса разрушения);
- при наличии концентраторов механических напряжений (канавки, пазы, отверстия и другие);
- при низкой чистоте обработанной поверхности, так как при этом возникают локальные короткозамкнутые гальванические пары;
- при значительной разнице температуры отдельных частей аппарата (образуются термогальванические элементы);
- при наличии застойных зон (щели, зазоры);
- при формировании остаточных напряжений, особенно в сварных соединениях (для их устранения необходимо предусмотреть термическую обработку – отжиг).
Методы оценки
Существует несколько способов оценки скорости разрушения металлов в агрессивных средах:
- Лабораторные – испытания образцов в искусственно смоделированных условиях, близких к реальным. Их преимуществом является то, что они позволяют сократить сроки исследования.
- Полевые – проводятся в естественных условиях. Занимают длительное время. Преимуществом такого метода является получение информации о свойствах металла в условиях дальнейшей эксплуатации.
- Натурные – испытания готовых металлических объектов в естественной среде.
Источник
Классификация коррозионных исследований:
Все методы исследования коррозионных процессов подразделяются на три группы:
— лабораторные исследования (испытания проводятся в лабораториях, где имитируют различные эксплуатационные условия металлов и сплавов);
— эксплуатационные исследования (исследования машин, агрегатов и различного оборудования, средств защиты в условиях их дальнейшей эксплуатации);
— внелабораторные исследования (испытания образцов в эксплуатационных естественных условиях, например, в море, на воздухе и т.п.).
Объектом исследования в лабораторных и внелабораторных испытаниях является металлический образец. Условия исследований разные.
При эксплуатационных и внелабораторных испытаниях условия коррозионной среды одинаковы, но в первом случае в качестве испытуемого выступает уже не образец, а готовое изделие, покрытие, агрегат и т.п.
Чаще всего проводят все три вида испытаний в следующей последовательности: лабораторные, внелабораторные, эксплуатационные. Каждый из вышеперечисленных методов имеет свои преимущества и изъяны, но вместе они, в какой-то степени, дополняют друг друга.
Также все методы коррозионных испытаний можно подразделить еще на две группы:
— ускоренные исследования;
— длительные испытания.
Ускоренные коррозионные испытания проводят в искусственно созданных условиях. При этом значительно ускоряются все коррозионные процессы, но их характер протекания не меняется. Обычно эффект ускорения достигается облегчением протекания контролирующих процессов.
Длительные коррозионные исследования по продолжительности не отличаются от естественных эксплуатационных.
Очень часто проводят оба вида коррозионных испытаний, т.к. они дополняют друг друга, но иногда обходятся без длительных исследований.