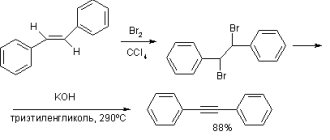
Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
Стабильные радикалы
Обычно радикалы «живут» мало и спешат скорее вступить в реакцию. Такие радикалы существуют секунды или доли секунд и называются нестабильными. Но есть те, что отличаются стабильностью, период существования их может достигать нескольких лет. В неорганической химии к стабильным относят O3, NO, ClO2, NO2 и другие. В разделе же органической больше стабильных радикалов. Их делят на несколько групп:
- углеводородные;
- гидразильные;
- нитроксильные;
- аминильные;
- ароксильные;
- вердазильные.
Вам будет интересно:Было или нет татаро-монгольское иго? Мнение историков
Механизм реакции радикального замещения
В механизме реакции выделяют три стадии:
- Инициирование. Посредством внешних факторов (нагревание, облучение, химические и электрические катализаторы) разрушается связь в молекуле вещества, образуя свободные радикалы.
- Развитие цепи или ее рост. Свободные элементы вступают во взаимодействие с молекулами, благодаря чему образуются новые вещества и радикалы.
- Обрыв цепи. На третьей стадии радикалы соединяются между собой. Происходит их рекомбинация (объединение неспаренных электронов, которые принадлежат разным частицам), благодаря чему появляются новые самостоятельные молекулы. Свободных радикалов не остается, и цепь реакции считается завершенной.
Алканы
Алканы – насыщенные углеводороды, содержащие только простые связи. Общая формула алканов – CnH2n+2. Насыщенными называются те углеводороды, которые содержат максимальное количество атомов водорода. Ранее алканы называли парафинами из-за того, что эти вещества не реагировали с кислотами, щелочами и т. д. На самом деле устойчивость к взаимодействию с сильными реагентами объясняется прочностью С-С и С-Н связей. Насыщенность алканов также говорит о том, что они не участвуют в реакциях присоединения. Для них характерны реакции разложения, замещения и прочие.
Влияние температуры на парофазное нитрование
Нитрование — реакция экзотермическая, которая проходит с выделением теплоты около 150 кДж / моль на каждую нитрогруппу, поэтому одной из важнейших условий успешного прохождения реакции является соблюдение температурного режима. Несоблюдение оптимальной температуры приводит или к энергичному окислению, или меняет характер замещения, степень нитрования и тому подобное. Также важно медленное добавление азотной кислоты или нитрующей смеси (капельно) к веществу, охлаждение и перемешивание реакционной смеси.
Готовые работы на аналогичную тему
Курсовая работа Парофазное нитрование 430 ₽ Реферат Парофазное нитрование 250 ₽ Контрольная работа Парофазное нитрование 210 ₽
Получить выполненную работу или консультацию специалиста по вашему учебному проекту Узнать стоимость
Механизм замещения на примере галогенирования метана
Простейшим алканом считается метан, поэтому реакции его галогенирования легко запомнить, и на этой основе проводить радикальное замещение других алканов. В качестве галогена обычно берется хлор. Он обладает средней силой реагирования. Реакция алканов с йодом не идет, так как он слабый галоген. Взаимодействие с фтором проходит со взрывом, потому что атомы фтора очень активны. Хотя при реакции замещения алканов с хлором тоже может произойти взрыв.
Зарождение цепи. Под воздействием солнечного, ультрафиолетового излучения или от нагревания молекула хлора Cl2 распадается на два свободных радикала. У каждого один неспаренный электрон на внешнем слое.
Cl2 → 2Cl
Развитие или рост цепи. Взаимодействуя с молекулами метана, свободные радикалы образуют новые и продолжают цепь превращений.
СН4 + Cl· → СН3 + HCl
СН3 + Cl2 → СН3Cl + Cl
Далее реакция идет до тех пор, пока не исчезнут все свободные радикалы.
Обрыв цепи – заключительная стадия радикального замещения алканов. Радикалы соединяются друг с другом и образуют новые молекулы.
СН3· + ·Cl → СН3Cl
СН3· + ·СН3 → СН3 – СН3
Химические свойства пропана:
Пропан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства пропана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование пропана:
- 2. галогенирование пропана:
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы пропана, отрывая у них атом водорода, в результате этого образуется свободный пропил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома :
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH3 + Br· → CH3-CH·-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH3 + Br· → CH3-CHBr-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование пропана проходит поэтапно – за один этап замещается не более одного атома водорода.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование пропана:
- 4. окисление (горение) пропана:
При избытке кислорода:
Горит желтым пламенем.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод (в различном виде, в т.ч. в виде графена , фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование пропана:
- 6. сульфоокисление пропана:
Хлорирование метана
Под действием солнечного света радикалы хлора замещают все атомы водорода в метане. Для полного замещения водорода доля хлора в смеси должна быть достаточной. Таким образом, из метана может получиться четыре его производных:
СН3Cl – хлорметан.
СН2Cl2 – дихлорметан.
CHCl3 – трихлорметан (хлоформ).
CCl4 – тетрахлорметан.
Взаимодействие алканов с азотной кислотой
Насыщенные углеводороды при обычной температуре не взаимодействуют с концентрированной азотной кислотой. При нагревании эта кислота действует как окислитель. Если же на алканы действует разбавленная азотная кислота при нагревании (140 ${}^\circ$С), то может происходить реакция нитрования, в результате которой атомы водорода в молекулах насыщенных углеводородов замещаются на нитрогруппу:
Рисунок 2. Взаимодействие алканов с азотной кислотой. Автор24 — интернет-биржа студенческих работ
Впервые реакцию нитрования алканов совершил в 1888 ${\rm M}$. И. Коновалов, поэтому ее называют реакцией Коновалова.
Скорость реакции нитрования алканов небольшая и выход нитросоединений достаточно низкий. Наилучшие результаты получают при нитровании алканов, имеющих третичные углеродные атомы. Нитрование алканов сопровождается окислительными процессами. На нитрование расходуется только около 40\% азотной кислоты, остальная кислота действует как окислитель. Поэтому при нитровании рядом с нитросоединениями образуются различные добавочные соединения — спирты, альдегиды, кетоны, кислоты. Нитрование алканов сопровождается также разрывом С-С-связей в их молекулах (крекингом), что ведет к образованию нитросоединений с меньшим количеством углеродных атомов, чем у исходного алкана. Так, при нитровании пропана образуется 34\% 1-нитропропана, 32\% 2-нитропропана, 26\% нитроэтана и 8\% нитрометана.
Азотную кислоту, как нитрующей реагент алканов, можно заменить оксидами азота ($\Pi $. П. Шорыгин, А. В. Топчиев, А. И. Титов).
Реакция нитрования алканов радикальный процесс. Начальной стадией этой реакции является взаимодействие углеводорода с оксидом азота (IV), который по строению является радикалом, и образование углеводородных радикалов.
Последние с оксидом азота (IV) дают нитросоединения:
Рисунок 3. Взаимодействие алканов с азотной кислотой. Автор24 — интернет-биржа студенческих работ
Оксид азота (IV) содержится в азотной кислоте и образуется также в результате окисления углеводородов азотной кислотой.
Галогенирование других алканов
Начиная с пропана (С3Н8) у алканов появляются третичные и вторичные атомы углерода. Галогенирование разветвленных алканов может давать разные результаты. В результате реакции радикального замещения образуются изомеры алканов. Масса каждого получившегося вещества может сильно различаться в зависимости от температуры.
При термическом галогенировании состав получившегося продукта определяется исходя из соотношения количества С―Н–связей атомов углерода, которые в сложных алканах бывают первичными, вторичными и третичными. В результате фотохимического галогенирования состав получившихся продуктов будет зависеть от скорости, с которой атомы галогена сменяют атомы водорода. Галогенам легче всего встать на место третичного атома водорода. Сложнее заместить вторичный и первичный.
Пропан, формула, газ, характеристики:
Пропан (лат. propanum) – органическое вещество класса алканов , состоящий из трех атомов углерода и восьми атомов водорода.
Химическая формула пропана C3H8, рациональная формула CH3CH2CH3. Изомеров не имеет.
Пропан – бесцветный газ, без вкуса и запаха. Однако в пропан, используемый в качестве технического газа, могут добавляться одоранты – вещества, имеющие резкий неприятный запах для предупреждения его утечки.
В природе содержится в природном газе , добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе . Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов ., в т.ч. сланцевой нефти.
Пожаро- и взрывоопасен.
Не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Пропан
по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Хлорирование пропана
При хлорировании пропана с катализатором в виде повышения температуры до 450 ⁰С образуются 2-хлорпропан в количестве 25 % и 1-хлорпропан в количестве 75 %.
2СН3СН2СН3 + 2Cl2 → СН3СН(Cl)СН3 + СН3СН2СН2Cl + 2HCl
Если проводить реакцию радикального замещения алкана с помощью солнечного света, выходит 57 % 2-хлорпропана и 43 % 1-хлорпропана.
Разница в массе полученных веществ между первой и второй реакцией объясняется тем, что во втором случае скорость замещения на атом Н у вторичного атома выше в 4 раза, чем у первичного, хотя в молекуле пропана больше первичных С―Н -связей.
Реакции окисления
В реакциях окисления алканов опять же участвуют свободные радикалы. В этом случае радикал О2 присоединяется к молекуле алкана, и происходит реакция полного или неполного окисления. Полное окисление называется горением:
СН4 + 2О2 → СО2 + 2Н2О
Реакция горения алканов по механизму радикального замещения широко используется в промышленности как топливо для ТЭЦ, для двигателей внутреннего сгорания. В такие машинные двигатели можно помещать только разветвленные алканы. Простые линейные алканы в ДВС взрываются. Из нелетучего осадка, образовавшегося в результате радикального замещения, производят смазки, асфальт, парафин и т. д.
Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.