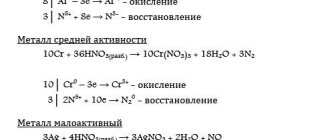Что это такое?
Рафинирование меди или электролиз использует анод, который содержит нечистую медь. Она возникает из-за концентрации руды. Катод состоит из чистого металла (титана или нержавеющей стали). Раствор электролита состоит из сульфата. Поэтому можно утверждать, что рафинирование меди и электролиз – это одно и то же. Электрический ток заставляет ионы меди из анодов поступать в раствор и осаждаться на катод. При этом примеси либо отходят, либо образуют осадок, либо остаются в растворе. Катод становится больше, чем чистая медь, а анод сжимается.
В электролитических ячейках используется внешний источник постоянного тока для реагирования на реакции, которые иначе не были бы спонтанными. Электролитические реакции используются для очистки пластинчатых металлов на многих типах субстратов.
Использование электролитического процесса для очистки металла (рафинирование меди, электролиз металла):
- Поскольку примеси могут значительно снизить проводимость медных проволок, необходимо очистить загрязненную медь. Одним из способов очистки является электролиз.
- Когда в качестве анода при электролизе водного препарата сульфата меди используется полоса из нечистой металлической меди, окисляется медь. Окисление ее протекает проще, чем окисление воды. Поэтому металлическая медь растворяется в растворе в виде ионов меди, оставляя за собой многие примеси (менее активные металлы).
- Ионы меди, образованные на аноде, мигрируют к катоду, где они легче восстанавливаются, чем вода и металлические «пластины» на катоде.
Необходимо пропускать достаточный ток между электродами, иначе в противном случае возникнет не спонтанная реакция. Тщательно регулируя электрический потенциал, металлические примеси, которые достаточно активны для окисления меди на аноде, вещества не уменьшаются на катоде, а металл избирательно осаждается.
Важно! Не все металлы восстанавливаются или окисляются легче, чем вода. Если это так, сначала произойдет электрохимическая реакция, требующая наименьшего потенциала. Например, если бы мы использовали электроды, как анод, так и катод, металлический потенциал был бы окислен на аноде, но тогда вода будет уменьшаться на катоде, а ионы алюминия останутся в растворе.
Чтобы создать электролиз, нужно использовать следующий способ рафинирования меди:
- Налейте раствор медного сульфата в стакан.
- Поместите два графитовых стержня в раствор сульфата меди.
- Присоедините один электрод к отрицательной клемме питания постоянного тока, а другой – к положительной клемме.
- Полностью заполните две маленькие пробирки раствором сульфата меди и поместите пробку на каждый электрод.
- Включите источник питания и проверьте, что происходит на каждом электроде.
- Испытайте любой газ, произведенный с пылающей шиной.
- Запишите свои наблюдения и результаты ваших тестов.
Результаты должны быть такими:
- Появляются бурые или розовые твердые формы в растворе.
- Есть пузыри.
- Пузыри должны быть бесцветными.
- Вещество газообразной формы.
Все результаты записываются, после чего газ гасится шиной. Также существует иной способ очистить металл от примесей и сторонней грязи – это огневое рафинирование меди. Как это происходит, расскажем позже, а сейчас представим другие варианты рафинирования металла.
Электролит
Составной частью электролита при электролизе меди являются медный купорос CuSO4•5H2O и техническая серная кислота (купоросное масло). Купоросное масло должно быть очищено от механических и химически связанных примесей. Концентрация медного купороса в электролите составляет; при производстве медных катодов 120—160 г/л, при производстве катодных основ 130—160 г/л. Водные растворы медного купороса являются слабыми проводниками электрического тока. Другая составляющая электролита — раствор серной кислоты — является хорошим проводником электрического тока. Введение в состав электролита серной кислоты сильно снижает его омическое сопротивление, вследствие чего улучшаются показатели по расходу тока. Содержание свободной серной кислоты в электролите составляет; при производстве медных катодов 125—180 г/л, при производстве катодных основ 100—160 г/л.
Для нормального ведения процесса электролиза меди необходимы циркуляция и подогрев электролита. Циркуляцию электролита осуществляют перекачиванием его кислотоупорными насосами в баки, из которых электролит самотеком поступает к ваннам. При расположении ванн по каскаду электролит последовательно проходит через несколько ванн. Скорость циркуляции по отдельным ваннам серии следует поддерживать одинаковой. Из ванн электролит отводится трубопроводом в сборный бак, из которого перекачивается снова в напорные баки. Перед поступлением в напорные баки электролит подогревается посредством паровых змеевиков, при этом повышается электропроводность и улучшается качество катодного осадка. Температура электролита должна быть 55—60°; слишком сильный нагрев электролита вызывает большой расход пара, а повышенное испарение влаги из электролита ухудшает условия работы в цехе. Для пополнения испарившейся воды в циркуляционную систему вводят конденсат, добавка водопроводной воды не допускается.
При уменьшении концентрации ионов меди в электролите и повышении концентрации примесей электродный потенциал меди становится менее электроположительным и может стать равным или меньше потенциала какой-либо примеси. Это приведет к тому, что примесь начнет выделяться на катоде. Во избежание осаждения примесей концентрацию ионов меди в электролите следует поддерживать в течение всего процесса электролиза в допустимом интервале. Обогащение электролита медью достигается введением в циркуляционную систему медного купороса; избыточное количество его удаляется в процессе регенерации.
Накапливающиеся в электролите примеси ухудшают его свойства: повышается вязкость, снижается электропроводность, вследствие этого ухудшается качество катодного осадка. Основными примесями при электролизе вторичной черновой меди являются: никель, сурьма, свинец. Для обновления состава электролита и удаления из него примесей периодически выводят из циркуляционной системы часть электролита на регенерацию.
Добавки в электролит
Ионы хлора в виде соляной кислоты вводят в состав электролита для снижения растворимости в нем серебра; концентрация ионов хлора равна 10—30 мг{л. Для улучшения структуры и повышения плотности катодного осадка меди в электролит вводят поверхностно активные вещества: столярный клей в количестве до 25 г на 1 г готовых катодов и сульфитцеллюлозный щелок до 30 г на 1 т катодов. При появлении рыхлого, пористого, шишковатого осадка добавляют тиомочевину со столярным клеем. Добавки вводят периодически или непрерывно в циркуляционную систему в виде очень разбавленных растворов.
Регенерация электролита
Обновление электролита достигается выводом части его из системы циркуляции. Количество отбираемого электролита определяется пределами допустимой концентрации наиболее характерной примеси — никеля. С увеличением концентрации сульфата никеля повышается сопротивление электролита, ухудшаются условия осаждения шлама и образования осадка меди, а также повышается содержание никеля в катодной меди. На Московском медеплавильном заводе единовременный вывод электролита на регенерацию составляет 50—55 м3 при содержании 170—180 г/л NiSO4 • 7H2O.
В специальном регенеративном отделении выведенный электролит подвергают электролизу с нерастворимыми анодами, в качестве которых используют листовой свинец толщиной около 5 мм. При электролизе с нерастворимыми анодами достигается разложение CuSO4 с выделением на аноде кислорода и образованием серной кислоты, а на катоде осаждается медь. Напряжение разложения равно разности электродных потенциалов анода и катода. Практически требуется напряжение на ванне 2,3—2,5 в.
Процесс осаждения меди длится около 20 час. После электролиза с нерастворимыми анодами электролит (8—10 г/л CuSO4 • 5H2O; 160—180 г/л NiSO4 • 7H2O и 180—200 г/л H2SO4), направляют на вакуумную выпарку, а затем раствор, насыщенный сульфатом никеля, нагретый до 60—70°, поступает на кристаллизацию. Никелевый купорос в кристаллическом виде является готовой продукцией. Маточник, содержащий до 600 г/л H2SO4, возвращают в процесс электролиза меди. Выделенная на катоде регенеративная медь имеет высокое содержание примесей. Она используется в плавильном цехе.
Способы рафинирования меди – как еще могут происходить химические зачистки нужных металлов?
Поскольку электролиз – это воздействие сульфатов и тока, что же такое электролитический способ получения чистой продукции? Совершенно разные вещи, хотя похожи в звучании названий. Однако электрическое рафинирование меди заключается в использовании кислот. Можно сказать, что это окисление металла, но не совсем.
Чистая продукция важна для изготовления электрического провода, поскольку электропроводность меди снижается за счет примесей. Эти примеси включают такие ценные металлы, как:
- серебро,
- золото;
- платина.
Когда они удаляются электролизом и восстанавливаются тем же путем, электроэнергии затрачивается столько, сколько бы хватило на расход электрического питания для снабжения десятков домов. Очищенный компонент позволяет сэкономить энергию, обеспечивая за меньшее время расхода энергии еще больше жилых домов.
При электролитическом рафинировании нечистый состав изготавливается из анода в электролитной ванне из сульфата меди – CuSO4 и серной кислоты H2SO4. Катод представляет собой лист очень чистой меди. По мере пропускания тока через раствор положительные ионы меди, Cu2+ притягиваются к катоду, где они берут на себя электроны и осаждаются, как нейтральные атомы, тем самым создавая на катоде все больше и больше чистого металла. Между тем, атомы в аноде отдают электроны и растворяются в растворе электролита в виде ионов. Но примеси в аноде не идут в раствор, потому что атомы серебра, золота и платины не так легко окисляются (превращаются в положительные ионы), как медь. Таким образом, серебро, золото и платина просто падают с анода на дно резервуара, где их можно очистить.
Но есть и электролитическое рафинирование меди, когда используются резервуары:
- Электролитические очистные резервуары – это отдельный цех в промышленном производстве. Анодные пластины подвешены «ручками» в резервуаре для очистки электролитической меди. Чистые медные катодные листы, подвешенные на сплошных стержнях, вставляются в один и тот же резервуар, один лист между каждым анодом. Когда электрический ток пропускается от анодов через электролит к катодам, медь из анодов перемещается в раствор и высаживается на лист стартера. Примеси из анодов оседают на дно резервуара.
- Литьевая машина с медными анодами (плитами). Он будет плавно превращаться в анодные пластины в пресс-формы. После предварительной обработки происходит удаление олова, свинца, железа, алюминия. Далее начинает заряжаться медный материал в печь, за которым следует процесс плавки.
- Когда примеси удаляются, следует удаление шлака и фаза восстановления с помощью природного газа. Снижение направлено на удаление свободного кислорода. После восстановления процесс заканчивается литьем, когда конечный продукт отливают в виде медных анодов. Такая же машина может использоваться для литья этих анодов во время переработки компонентов или для переработки анодов для металлолома на электролизном медеплавильном заводе.
- Чистые катодные листы. Модифицирующие аноды, извлеченные из рафинирующей печи, превращаются в электролитическую медь с чистотой 99,99 % в процессе электролиза. Во время электролиза ионы меди оставляют нечистый медный анод и, поскольку они являются положительными, мигрируют в катод.
Время от времени чистый металл соскабливается с катода. Примеси из медного анода, такие как золото, серебро, платина и олово, собираются на дне раствора электролита, осаждаются как анодная слизь. Этот процесс и называется электролитическим получением и рафинированием меди.
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
Получение ископаемого – какие виды существуют и все ли они необходимы на практике?
Несколько отличается иной способ очистки металла. Есть еще рафинирование меди огневое и электролитическое, когда один процесс сразу следует за другим. Важным «разделяющим» этапом становится концентрация или концентрирование. После того, как концентрация завершена, следующий этап в создании готовой продукции – огневое рафинирование меди.
Обычно это происходит недалеко шахты, на обогатительной фабрике или плавильном заводе. Благодаря медной очистке нежелательный материал постепенно удаляется, а медь концентрируется с чистотой до 99,99 % марки А. Детали процесса переработки зависят от типа минералов, с которыми связан металл. Медная руда, богатая сульфидами, обрабатывается пирометаллургическим способом.
Переработка и пирометаллургия:
- В пирометаллургии медный концентрат сушат перед нагреванием в печи. Химические реакции, возникающие в процессе нагрева, заставляют концентрат разделяться на два слоя материала: матовый слой и слой шлака. Матовый слой на дне содержит медь, а слой шлака сверху содержит примеси.
- Шлак отбрасывается и матовый слой восстанавливается и перемещается в цилиндрический сосуд, называемый преобразователем. В конвертер добавляются различные химикаты, которые реагируют с медью. Это приводит к образованию превращенной меди, называемой «блистерной». Осажденная она извлекается и затем подвергается другому процессу, называемому огнеочисткой.
- В огнеочистке воздух и природный газ продуваются, чтобы удалить оставшуюся серу и кислород, в результате чего очищенный состав перерабатывается в катод. Металл отливается в аноды и помещается в электролизер. После зарядки чистая медь собирается на катоде и удаляется в виде 99 % чистого продукта.
Переработка и гидрометаллургия:
- В гидрометаллургии медный концентрат подвергается переработке через один из нескольких процессов. Наименее распространенным методом является цементация, где металл осаждается на металлолом в реакции окисления-восстановления.
- Более широко используемый метод очистки – это экстракция растворителем и электролиз. Эта новая технология получила широкое распространение в 1980-х годах, и примерно 20 % мировой меди в настоящее время производится так.
- Экстракция растворителем начинается с органического растворителя, который отделяет металл от примесей и нежелательных материалов. Затем добавляют серную кислоту для отделения меди от органического растворителя, получая электролитический раствор.
- Затем этот раствор подвергают электролизному процессу, который просто ставит медь в растворе на катод. Этот катод может быть продан как есть, но также может быть превращен в стержни или исходные листы для других электролизеров.
Горнодобывающие компании могут продавать медь в концентрате или катодной форме. Как упоминалось выше, концентрат чаще всего рафинируется в другом месте, не на шахтном участке. Производители концентратов продают концентрат-порошок, содержащий от 24 до 40 % меди, в медеплавильные и нефтеперерабатывающие заводы. Условия продажи уникальны для каждого завода, но в целом плавильный завод выплачивает шахтеру примерно 96 % стоимости содержания меди в концентрате, за вычетом платы за обработку и расходов на очистку.
Как правило, плавильные заводы взимают пошлины за проезд, но они также могут продавать рафинированный металл от имени горняков. Таким образом, весь риск (и вознаграждение) от колебаний цен на медь приходится на плечи перекупщиков.
Электролиз меди
Медь нашла свое широкое применение во многих сферах, а ее главным «козырем» является высокая электропроводность. Для ее получения необходимы природные руды, содержащие ее, которых в природе насчитывается более 30 видов.
Электролиз меди – это один из этапов химико-физических процессов, которому подвергается руда для того. Интересно, что для получения 1 тонны данного метала, требуется переработать не менее 200 тонн медной руды.
Возможно Вас также заинтересует статья о технологии обратного осмоса.
Огневое рафинирование – насколько это опасно?
Самое «ходовое» огневое рафинирование не может быть не опасным, однако в настоящее время метод обработки используется на большинстве промышленных предприятий. Отдельно стоит описать технологию рафинирования черновой меди.
Блистерная медь уже практически чиста (более 99 % меди). Но для сегодняшнего рынка это не очень «чисто». Металл дополнительно очищают, используя электролиз. В промышленном производстве используют метод, который называется огневое рафинирование черновой меди. Чернильная медь отливается в большие плиты, которые будут использоваться в качестве анодов в электролизере. Электролитическое дополнительное рафинирование производит высококачественный металл высокой чистоты, требуемый промышленностью.
В промышленности это осуществляется в массовом масштабе. Даже лучший химический метод не может удалить все примеси из меди, но при помощи электролитического рафинирования можно получить чистую медь на 99,99 %.
- Анодные блистеры погружаются в электролит, содержащий сульфат меди и серную кислоту.
- Между ними расположены чистые катоды, и через раствор проходит ток более 200 А.
В этих условиях атомы меди растворяются из нечистого анода с образованием ионов меди. Они мигрируют к катодам, где осаждаются обратно, как чистые атомы меди.
- На аноде: Cu(s) → Cu2 + (aq) + 2e-.
- На катоде: Cu2 + (aq) + 2e- → Cu(s).
Когда переключатель закрывается, ионы меди на аноде начнут двигаться через раствор к катоду. Атомы меди уже отказались от двух электронов, чтобы стать ионами, и их электроны могут свободно перемещаться в проводах. Закрытие переключателя толкает электроны по часовой стрелке и заставляет оседать в растворе некоторые ионы меди.
Пластина отталкивает ионы от анода к катоду. В то же время она толкает свободные электроны вокруг проводов (эти электроны уже распределены по проводам). Электроны в катоде рекомбинируют с ионами меди из раствора, образуя новый слой атомов меди. Постепенно анод разрушается, а катод растет. Нерастворимые примеси в аноде падают на дно в осадок. Этот ценный биопродукт удаляется.
Золото, серебро, платина и олово нерастворимы в этом электролите, и поэтому не осаждаются на катоде. Они образуют ценный «ил», который накапливается под анодами.
Растворимые примеси железа и никеля растворяются в электролите, который необходимо постоянно очищать, чтобы предотвратить чрезмерное осаждение на катоды, что уменьшит чистоту меди. Недавно катоды из нержавеющей стали заменили медными катодами. Происходят идентичные химические реакции. Периодически катоды удаляются, и очищается чистая медь. Электролитическое получение и рафинирование меди в данных условиях довольно часто встречается на заводах по переработке цветных металлов.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
Электрохимический вариант очищения металла
Огневая очистка может быть названа химической, потому как в этом процессе происходит химическая реакция с другими веществами и примесями. Выше был приведен пример окислительной реакции. Все виды и способы добычи чистой меди похожи, как и электрохимическое рафинирование меди, где применяются идентичные тактики, но в разной последовательности.
Химическим вспомогательным элементом становится сам побочный продукт:
- Едкий натр.
- Хлор.
- Водород.
Это самый дешевый способ получить дорогое сырье, не тратясь на альтернативную систему добычи компонентов. Помимо этого, добываются ценные металлы, которые благородны по составу и ценны в промышленном изобретении электроприборов.
Печь меди – металлическая кулинария промышленности
Печь огневого рафинирования меди сконструирована по-особенному и способна обрабатывать медный лом в жидкий металл с контролируемым содержанием примесей. Она предназначена для пирометаллургической переработки лома по экономичной и экологически чистой технологии. Основная технология, предлагаемая для производства расплавленной меди, подходит для производства медной палочки, полосы, заготовки или других медных изделий с использованием лома в качестве сырья (Cu> 92 %).
Потенциал систем сжигания и очистки был рассчитан для цикла очистки (от зарядки до восстановления) в течение 16-24 часов, в зависимости от типа лома. Печи рафинирования меди обладают особой конструкцией и функциями:
- Корпус печи выполнен из стальных сегментов и жестких конструкций типа сечения.
- Печь облицована огнеупорным материалом изнутри.
- Она оснащена гидравлической станцией, работающей в режиме опрокидывания печи с двумя скоростями: скоростью ползучести при наклоне для литья и высокой скоростью во время перемещения, которая не требует особой точности.
- Операции выполняются при помощи двух гидравлических цилиндров, установленных на дне печи. Специальное устройство возвращает печь в горизонтальное положение во время аварийных отключений питания.
- Загрузочный люк материала расположен в боковине печи. Он закрывается дверью, приводимой в движение от гидравлического цилиндра.
- Печь оснащена охлаждаемыми копьями для операций окисления и восстановления меди.
Также есть одна универсальная горелка, потребляющая как жидкое, так и газообразное топливо.
Окислительное рафинирование в промышленности
Операция окисления меди проводится после завершения плавки исходного сырья. Процесс осуществляют путем впрыскивания сжатого воздуха в расплав через фурмы. Полученный шлак удаляют вручную с поверхности расплава при помощи специальных граблей и сбрасывают в контейнер. Шлак содержит медь, примеси, свинец, олово и т. д. Процесс восстановления должен проводиться для удаления кислорода из расплава и восстановления оксидов меди. Операция выполняется путем впрыскивания природного газа в расплав.
Из печи, отходящие газы, подаются в систему газоочистки, проходят через пылесборник, который захватывает грубую пыль. Коллектор снабжен вентиляционной трубой в случае аварийного выброса газа в атмосферу. Печь для огнеочистки работает в непрерывном режиме. Цикл работы технологического процесса включает:
- загрузку сырья;
- окисление, шлакообразование, восстановление;
- загрузку рафинированного металла.
Весь последующий процесс называется окислительное рафинирование меди. Он не может быть отделен от общего процесса очистки, так как является частью всего метода получения чистого металла. После того как требуемые параметры будут устранены, расплав меди используется для следующего технологического процесса.
Количество осаждаемой меди и расход электроэнергии
Постоянный электрический ток для электролиза меди подается от машинных генераторов или ртутных преобразователей. Сила тока в цепи электролитных ванн равняется 5000 а и более. Катодная плотность тока, равная величине силы тока, приходящейся на 1 м2 катодной поверхности при производстве меди из вторичного сырья, составляет 170—200 а. При электролизе с растворимым анодом, когда оба электрода медные, потенциалы их в одном растворе практически одинаковы, на выделение меди требуется ничтожно малое напряжение тока. В основном напряжение расходуется на преодоление омического сопротивления электролита и в меньшей степени на другие сопортивления. Для рафинирования меди, полученной из вторичного сырья, напряжение на ванне равно 0,18—0,4 в. Если сила тока равна 1 а, значит каждую секунду по проводнику проходит 1 к (кулон) электричества, а за один час 3600 к. Для выделения одного грамм-эквивалента (грамм-эквивалент равен атомному весу, выраженному в граммах к поделенному на валентность) вещества при электролизе требуется 96500 к, или 96500/3600 = 26,8 а-ч. 1 г-экв двухвалентной меди равен 63,57/2 = 31,78 г.
1 а-ч выделит 31,78/26,8 = 1,186 г. меди.
Для выделения 1 кг меди теоретически требуется 1000/1,186 = 843 а-ч,
а для выделения 1 т меди — 843 000 а-ч.
В производственных условиях на выделение 1 т потребуется тока несколько больше вследствие потерь, в результате коротких замыканий, побочных электрических цепей и т. д. Коэффициент полезного использования тока Кт (выход по току) равен отношению теоретически необходимого количества тока к фактическим его затратам.
Расход электроэнергии на 1 г меди равняется количеству израсходованного тока в ампер-часах, умноженному на падение напряжения между электродами и поделенному на коэффициент использования тока:
Иодидное рафинирование цветных металлов
Ионы меди (II) окисляют иодидные ионы до молекулярного йода, и в этом процессе сами сводятся к иодиду меди (I). Исходная смешанная коричневая смесь разделяется на не совсем белый осадок иодида меди (I) в растворе йода. Используют эту реакцию для определения концентрации ионов меди (II) в растворе. Если добавить в колбу установленный объем раствора, содержащего ионы меди (II), а затем добавить избыток раствора йодида калия, вы получите описанную выше реакцию.
2Cu2+ + 4I- → 2CuI (s) + I2 (водный раствор)
Вы можете найти количество йода, высвобождаемого титрованием раствором тиосульфата натрия.
2S2O2-3 (раствор) + I2 (раствор) → S4O2-6 (водный раствор) + 2I- (водный раствор)
Когда раствор тиосульфата натрия запускается из бюретки, цвет йода исчезает. Когда это почти все исчезнет, добавьте крахмал. Вся реакция иодидного рафинирования меди будет обратимой с йодом для получения глубокого синего крахмал-йодного комплекса, который намного легче увидеть.
Добавляйте последние несколько капель раствора тиосульфата натрия до тех пор, пока синий цвет не исчезнет. Если вы проследите пропорции через два уравнения, вы обнаружите, что для каждых 2 молей ионов меди (II), с которыми вы должны были начать, вам нужно 2 моля раствора тиосульфата натрия. Если вы знаете концентрацию раствора тиосульфата натрия, легко подсчитать концентрацию ионов меди (II). Результатом этой попытки является получение простого соединения меди (I) в растворе.
Фосфористая обработка
Рафинирование меди фосфористой – это фосфорная дезоксидированная жесткая медь, которая представляет собой прочную смолу общего назначения. Она раскисляется фосфором меди, в которой остаточный фосфор поддерживается на низком уровне (0,005-0,013 %) для достижения хорошей электропроводности. Обладает хорошей теплопроводностью и отличными свойствами сварки и пайки. Оксид после рафинирования меди таким способом, оставшийся в твердой смоле меди, удаляется фосфором, который является наиболее часто используемым дезоксидантом.
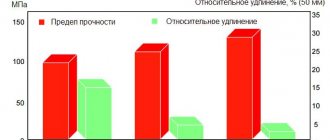
В таблице показана разные показатели от отожженного (мягкого) до жесткого состояния меди.
| Прочность на растяжение | 220-385 Н/мм2 |
| Прочность на разрыв | 60-325 Н/мм2 |
| Удлинение | 55-4 % |
| Твердость (HV) | 45-155 |
| Электропроводность | 90-98 % |
| Теплопроводность | 350-365 Вт/см |
Ведущие рамы соединяют проводку с электрическими клеммами на поверхности полупроводника и крупномасштабными схемами на электрических устройствах и печатных платах. Материал выбирается так, чтобы соответствовать требованиям процесса и быть надежным при установке и эксплуатации.