В этой статье:
1. Свойства алюминия
2. Сплавы алюминия
3. Сырые материалы для производства алюминия 3.1. Руды алюминия
3.2. Бокситы
3.3. Нефелины
3.4. Алуниты
3.5. Другие сырые материалы
3.6. Производство криолита
4. Рафинирование алюминия
Алюминий впервые выделен в свободном виде в 1825 г. датским физиком Эрстедом. В настоящее время в промышленных масштабах алюминий получают электролитическим путем. Способ получения металлического алюминия электролизом глинозема, растворенного в криолите, запатентовали в 1886 г. независимо друг от друга Поль Эру во Франции и Чарльз Хол в США.
Производство алюминия развивалось с тех пор чрезвычайно быстрыми темпами, благодаря тому значению, которое приобрел алюминий в промышленности. До 1917 г. наша страна не имела собственного алюминиевого завода, хотя русские ученые внесли большой вклад в металлургию алюминия. В 1929 г. на ленинградском был получен алюминий на Волховской энергии и на отечественном сырье. В 1932 г. пущен в строй Волховский алюминиевый завод, а в 1933 г. — Днепровский алюминиевый завод. В дальнейшем были построены алюминиевые заводы в различных районах нашей страны.
Создание мощной энергетической базы позволило нашей стране быстро выйти на одно из первых мест по производству алюминия.
Свойства алюминия
В чистом виде алюминий — металл серебристого белого цвета. Одно из важных свойств алюминия — его малая плотность: в твердом состоянии (при 20° С) она равна 2,7 г/см3, а в жидком виде (при 900° С) — 2,32 г/см3. Температура плавления высокочистого алюминия (99,996%) равна 660,24° С, температура кипения — 2500° С. Важными свойствами алюминия, определяющими его применение во многих областях промышленности, являются его хорошая электропроводность и теплопроводность.
Алюминий хорошо обрабатывается механически, обладает хорошей ковкостью, легко прокатывается в тончайший лист и проволоку. В химических реакциях алюминий амфотерен. Он растворяется в щелочах, соляной и серной кислотах, но стоек по отношению к концентрированной азотной и органическим кислотам. На внешней М-оболочке алюминия три валентных электрона, причем два — на 3s- орбите и один на 3p-орбите. Поэтому обычно в химических соединениях алюминий трехвалентен. Однако в ряде случаев алюминий может терять один p-электрон и проявлять себя одновалентным, образуя соединения низшей валентности.
Производство алюминия в настоящее время включает в себя две основные операции:
- получение безводной, свободной от сопутствующих алюминию примесей, окиси алюминия путем сложной химической переработки природных соединений (бокситов, глины, каолина);
- получение металлического алюминия методом электролиза глинозема, растворенного в криолите.
Алюминий обладает многими ценными свойствами: небольшой плотностью— около 2,7 г/см3, высокой теплопроводностью — около 300 Вт/(м • К) и высокой электропроводностью 13,8 • 107 Ом/м, хорошей пластичностью и достаточной механической прочностью.
Алюминий образует сплавы со многими элементами. В сплавах алюминий сохраняет свои свойства. В расплавленном состоянии алюминий жидкотекуч и хорошо заполняет формы, в твердом виде он хорошо деформируется и легко поддается резанию, пайке и сварке.
Сродство алюминия к кислороду очень большое. При его окислении выделяется большое количество тепла (~ 1670000 Дж/моль). Тонкоизмельченный алюминий при нагревании воспламеняется и сгорает на воздухе. Алюминий соединяется с кислородом воздуха и в атмосферных условиях. При этом алюминий покрывается тонкой (толщиной ~ 0,0002 мм) плотной пленкой окиси алюминия, защищающей его от дальнейшего окисления; поэтому алюминий стоек против коррозии. Поверхность алюминия хорошо защищается от окисления этой пленкой и в расплавленном состоянии.
Промышленный металл
Революционная технология электролитического восстановления оксида алюминия (Al2O3), растворенного в расплавленном криолите, была независимо открыта в 1886 году американцем Чарльзом Холлом и французом Полем Эру. Это событие совпало с тремя не менее революционными прорывами в технике [1]:
- Как раз в это время появились первые транспортные средства на двигателях внутреннего сгорания и ценность алюминия, как конструкционного материала, резко возросла.
- Во-вторых, электрификация потребовала огромного количества легкого электропроводного материала для передачи электроэнергии на большие расстояния и строительства опор для поддержки электрических кабелей.
- В третьих, братья Райт, в те же времена дали толчок развитию новой отрасли промышленности – самолетостроению, в которой алюминий был просто не заменим. Из алюминия изготавливали самолетные рамы, двигатели и другие детали и агрегаты. Вслед за самолетами появились ракеты, а затем и космические аппараты, в которых легкий алюминий является основным конструкционным материалом.
Сплавы алюминия
Из сплавов алюминия наибольшее значение имеют дюралюминий и силумины.
В состав дюралюминия, кроме алюминия, входят 3,4—4 % Cu, 0,5 % Mn и 0,5 % Mg, допускается не более 0,8 % Fe и 0,8 % Si. Дюралюминий хорошо деформируется и по своим механическим свойствам близок к некоторым сортам стали, хотя он в 2,7 раза легче стали (плотность дюралюминия 2,85 г/см3).
Механические свойства этого сплава повышаются после термической обработки и деформации в холодном состоянии. Сопротивление на разрыв повышается со 147—216 МПа до 353— 412 МПа, а твердость по Бринелю с 490—588 до 880—980 МПа. При этом относительное удлинение сплава почти не изменяется и остается достаточно высоким (18—24 %).
Силумины — литейные сплавы алюминия с кремнием. Они обладают хорошими литейными качествами и механическими свойствами.
Алюминий и сплавы широко применяют во многих отраслях промышленности, в том числе в авиации, транспорте, металлургии, пищевой промышленности и др. Из алюминия и его сплавов изготовляют корпуса самолетов, моторы, блоки цилиндров, коробки передач, насосы и другие детали в авиационной, автомобильной и тракторной промышленности, сосуды для хранения химических продуктов. Алюминий широко применяют в быту, пищевой промышленности, в ядерной энергетике и электронике. Многие части искусственных спутников нашей планеты и космических кораблей изготовлены из алюминия и его сплавов.
Вследствие большого химического сродства алюминия к кислороду его применяют в металлургии как раскислитель, а также для получения при использовании так называемого алюминотермического процесса трудно восстанавливаемых металлов (кальция, лития и др.). По общему производству металла в мире алюминий занимает второе место после железа.
Прочность
Прочность при растяжении
Промышленный чистый алюминий имеет прочность при растяжении около 90 МПа. Поэтому полезность нелегированного алюминия как конструкционного материала в значительной степени ограничена. После обработки металла, например, холодной прокаткой, его прочность может быть увеличена в 1,5-2 раза (рисунок 1.2).
Рисунок 1.2 – Влияние холодной деформации (нагартовки) на прочностные и пластические свойства марки алюминия 1050 [5]
Намного большее увеличение прочности может быть получено путем легирования алюминия не большими количеством одного и нескольких других элементов, таких как, марганец, кремний, медь, магний или цинк. Подобно чистому алюминию некоторые сплавы также можно упрочнять путем холодной пластической обработки. Другие сплавы получают свою высокую прочность путем их термического упрочнения (рисунок 1.2).
Рисунок 1.2 – Сравнение прочности характерных алюминиевых сплавов и низкоуглеродистой стали [5]
На рисунке 1.3 показаны уровни прочности характерных алюминиевых сплавов в сравнении со сталями, титановыми сплавами и магниевыми сплавами.
Рисунок 1.3 – Сравнение прочности при растяжении алюминия и алюминиевых сплавов с основными конкурирующими металлами [1]
Удельная прочность
Алюминий имеет плотность только 2,7 грамма на кубический сантиметр по сравнению с 7,9 для сталей, 8,93 для меди и 8, 53 для латуни. Важной характеристикой для конструкционных материалов является их удельная прочность, то есть отношение их прочности к массе (рисунок 2).
Рисунок 2 – Сравнение удельной прочности алюминия и алюминиевых сплавов с основными конкурирующими конструкционными металлами [1]
Сырые материалы для производства алюминия
Основным современным способом производства алюминия является электролитический способ, состоящий из двух стадий. Первая — это получение глинозема (Al2O3) из рудного сырья и вторая — получение жидкого алюминия из глинозема путем электролиза.
Руды алюминия
Вследствие высокой химической активности алюминий встречается в природе только в связанном виде: корунд Al2O3, гиббсит Al2O3 • ЗН2O, бемит Al2O3 • Н2O, кианит 3Al2O3 • 2SiO2, нефелин (Na, К)2O • Al2O3 • 2SiO2, каолинит Al2O3 • 2SiO2 • 2Н2О и другие. Основными используемыми в настоящее время алюминиевыми рудами являются бокситы, а также нефелины и алуниты.
Бокситы
Алюминий в бокситах находится главным образом в виде гидроксидов алюминия (гиббсита, бемита и др.), корунда и каолинита. Химический состав бокситов довольно сложен. Они часто содержат более 40 химических элементов. Содержание глинозема в них составляет 35—60 %, кремнезема 2—20 %, оксида Fe2O3 2—40 %, окиси титана 0,01—10 %. Важной характеристикой бокситов является отношение содержаний в них Al2O3 к SiO2 по массе — так называемый кремневый модуль.
Кремневый модуль бокситов, поступающих для получения глинозема, должен быть не ниже 2,6. Для бокситов среднего качества этот модуль составляет 5—7 при 46—48 %-ном содержании Al2O3, а модуль высококачественных — около 10 при 50 %-ном содержании Al2O3. Бокситы с более высоким содержанием Al2O3 (52 %) и модулем (10—12) идут для производства электрокорунда.
К числу крупных месторождений бокситов в нашей стране относится Тихвинское (Ленинградская область), Североуральское (Свердловская область), Южноуральское (Челябинская область), Тургайское и Краснооктябрьское (Кустанайская область).
Нефелины
Нефелины входят в состав нефелиновых сиенитов и уртитов. Большое месторождение уртитов находится на Кольском полуострове. Основные компоненты уртита — нефелин и апатит ЗСа3(РO4)2 • СаF2. Их подвергают флотационному обогащению с выделением нефелинового и апатитового концентратов. Апатитовый концентрат идет для приготовления фосфорных удобрений, а нефелиновый — для получения глинозема. Нефелиновый концентрат содержит, %: 20—30 Al2O3, 42—44 SiO2, 13-14 Na2O, 6-7 К2O, 3-4 Fe2O3 и 2-3 СаО.
Алуниты
Алуниты представляют собой основной сульфат алюминия и калия (или натрия) К2SO4 • Al2(SO4)3 • 4Al(ОН)3. Содержание Al2O3 в них невысокое (20—22 %), но в них находятся другие ценные составляющие: серный ангидрид SO3 (~ 20 %) и щелочь Na2O • К2O (4—5 %). Таким образом, они, так же как и нефелины, представляют собой комплексное сырье.
Другие сырые материалы
При производстве глинозема применяют щелочь NaОН, иногда известняк СаСО3, при электролизе глинозема криолит Na3AlF6 (3NaF•AlF3) и немного фтористого алюминия AlF3, а также СаF2 и MgF2.
Производство криолита
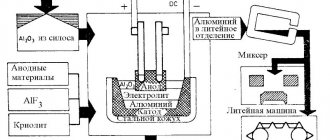
Криолит в естественном виде в природе встречается очень редко и его производят искусственно из концентрата плавикового шпата (СаF2). Процесс осуществляют в две стадии, первая — это получение плавиковой кислоты HF. Тонкоизмельченный СаF2 смешивают с серной кислотой в трубчатых вращающихся печах при 200 °С. В печи протекает реакция: СаF2+Н2SO4=2НF+СаSO4. Поскольку в плавиковом шпате содержится в качестве примеси SiO2, образуется также немного летучей кремнефтористой кислоты Н2SiF6. Газообразные НF и Н2SiF6 после их очистки от примесей поглощаются в вертикальных башнях водой, в результате получают раствор плавиковой кислоты с кремнефтористой. Его очищают от Н2SiF6, добавляя немного соды: Н2SiF6+Na2CO3=Na2SiF+Н2O+СO2. Кремнефтористый натрий выпадает в осадок и получается очищенная плавиковая кислота. Вторая стадия — получение криолита. В раствор плавиковой кислоты добавляют Аl(ОН)3 и соду и проводят так называемый процесс варки криолита, в течение которого протекают следующие реакции:
6НF + Al(ОН)3 = Н3АlF6 + 3Н2O
2Н3АlF6 + 3Na2CO3 = 2Na3AlF6 + ЗСO2 + 3Н2O.
Криолит выпадает в осадок, его отфильтровывают и просушивают при температуре 130—150 °С.
Фтористый алюминий получают схожим способом, добавляя к плавиковой кислоте до полной ее нейтрализации гидроксид алюминия: 3HF + Al(OH)3 = AlF3 + 3H2O.
Автомобильный транспорт
Одним из основных требований к материалам, применяемым в автомобильном транспорте, является малая масса и достаточно высокие показатели прочности. Принимаются во внимание также коррозионная стойкость и хорошая декоративная поверхность материала.
Рисунок 3 – Автомобиль
Высокая удельная прочность алюминиевых сплавов увеличивает грузоподъемность и уменьшает эксплуатационные расходы передвижного транспорта. Высокая коррозионная стойкость материала продляет сроки эксплуатации, расширяет ассортимент перевозимых товаров, включая жидкости и газы с высокой агрессивной концентрацией.
При изготовлении элементов каркаса, обшивки кузова полуприцепа автофургона, рефрижератора, скотовоза и т.п. перспективным материалом являются алюминиевые сплавы АД31, 1915 (прессованные профили) и сплавы АМг2, АМг5 (лист).
Находят применение алюминиевые сплавы АМц, АМгЗ и 1915 при изготовлении отдельных узлов легкового автомобиля (навесные детали, бамперы, радиаторы охлаждения, отопители).
В автомобилестроении США широко используются алюминиевые свариваемые сплавы серии Зххх, 5ххх и 6ххх.
Из прессованных полуфабрикатов сплавов 2014 и 6061 изготовляют балки, рамы тяжелых грузовых автомобилей. Панели и отдельные элементы из сплава 5052 поступают на изготовление кабины. В качестве обшивочного материала кузова грузовика используют лист из сплавов 5052, 6061, 2024, 3003 и 5154. Стойки кузова выполняются из прессованных полуфабрикатов сплавов 6061 и 6063. Магналиевые сплавы серии 5ххх (5052, 5086, 5154 и 5454) являются основным материалом при изготовлении автоцистерн.
Рафинирование алюминия
Алюминий, извлекаемый из электролизных ванн, называют алюминием-сырцом. Он содержит металлические (Fe, Si, Cu, Zn и др.) и неметаллические примеси, а также газы (водород, кислород, азот, оксиды углерода, сернистый газ). Неметаллические примеси — это механически увлеченные частицы глинозема, электролит, частицы футеровки и др.
Для очистки от механически захваченных примесей, растворенных газов, а также от Na, Са и Мg алюминий подвергают хлорированию. Для этого в вакуум-ковш вводят трубку, через которую в течение 10—15 мин подают газообразный хлор, причем для увеличения поверхности соприкосновения газа с металлом на конце трубки крепят пористые керамические пробки, обеспечивающие дробление струи газа на мелкие пузырьки. Хлор энергично реагирует с алюминием, образуя хлористый алюминий AlCl3. Пары хлористого алюминия поднимаются через слой металла и вместе с ними всплывают взвешенные неметаллические примеси, часть газов и образующиеся хлориды Na, Са, Мg и Н2.
Далее алюминий заливают в электрические печи-миксеры или в отражательные печи, где в течение 30—45 мин происходит его остаивание. Цель этой операции — дополнительное очищение от неметаллических и газовых включений и усреднение состава путем смешения алюминия из разных ванн. Затем алюминий разливают либо в чушки на конвейерных разливочных машинах, либо на установках непрерывного литья в слитки для прокатки или волочения. Таким образом получают алюминий чистотой не менее 99,8 % Аl.
Алюминий более высокой степени чистоты в промышленном масштабе получают путем последующего электролитического рафинирования жидкого алюминия по так называемому трехслойному методу. Электролизная ванна имеет стенки из магнезита, угольную подину (анод) и подвешенные сверху графитированные катоды. На подину через боковое отверстие порциями заливают исходный алюминий, поддерживая здесь анодный слой определенной толщины; выше него располагается слой электролита из фтористых и хлористых солей, а над электролитом — слой очищенного алюминия, который легче электролита; в этот слой погружены концы катодов.
Для того, чтобы рафинируемый алюминий находился внизу, его утяжеляют, формируя в анодном слое сплав алюминия с медью (в слое растворяют 30—40 % Сu). В процессе электролиза ионы Al3+перемещаются из анодного слоя через слой электролита в катодный слой и здесь разряжаются. Накапливающийся на поверхности ванны чистый катодный металл вычерпывают и разливают в слитки. Этим способом получают алюминий чистотой 99,95—99,99%. Расход электроэнергии равен ~ 18000 кВт • ч на 1 т алюминия. Более чистый алюминий получают методом зонной плавки или дистилляцией через субгалогениды.