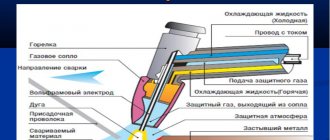
Железо: примесь и легирующий элемент
Железо является главной и наиболее опасной примесью в большинстве промышленных литейных и деформированных алюминиевых сплавов. Поэтому содержание железа в алюминиевых сплавах строго ограничивают, в некоторых сплавах – до 0,05 %.
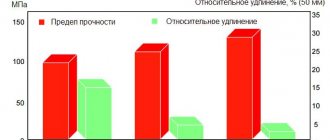
С другой стороны, железо является главным компонентом в материалах на основе алюминия, которые производят с применением новых технологий. Например, в аморфных и нанокристаллических сплавах содержание железа составляет более 10 %. Эти материалы обладают рекордным уровнем прочности до 1500 МПа.
Источники примесей в алюминии
Обычный алюминий и его сплавы неизбежно содержат примеси, то есть химические элементы, которые специально не вводят в состав сплава. Примеси, включая железо, имеют различное происхождение. Они могут попадать из руды, могут входить в металл в процессе электролиза и не всегда полностью удаляются в процессе производства и рафинирования первичного алюминия. Примеси могут возникать в процессе плавления и разливки из-за загрязнения шихты, взаимодействия металла с футеровкой и флюсами, а также из-за растворения элементов литейного оборудования и литейного инструмента. Кроме того, большое количество примесей может поступать при переплавке алюминиевых отходов.
Алюминий
- Реакции с неметаллами
- Реакции с кислотами и щелочами
- Реакция с водой
- Алюминотермия
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой — Al2O3)
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + HCl → AlCl3 + H2
Al + H2SO4(разб.) → Al2(SO4)3 + H2↑
Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
Al + HNO3(разб.) → (t) Al(NO3)3 + N2O + H2O
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы):
Na[Al(OH)4] → (t) NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Fe2O3 + Al → (t) Al2O3 + Fe
Cr2O3 + Al → (t) Al2O3 + Cr
MnO2 + Al → (t) Al2O3 + Mn
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Al + O2 → Al2O3
Al(OH)3 → (t) Al2O3 + H2O↑
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
AlBr3 + LiOH → Al(OH)3↓ + LiBr
Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 — по аниону)
Al2S3 + H2O → Al(OH)3↓ + H2S↑
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
Неметаллические примеси в алюминии
Главными неметаллическими примесями в алюминии являются кислород и водород. Кислород имеет низкую растворимость в жидком и твердом алюминии, а водород – высокую растворимость в жидком алюминии и чрезвычайно низкую растворимость в твердом алюминии. Кислород образует оксиды. Водород, растворенный в жидком алюминии, выделяется при его затвердевании и приводит к образованию усадочной пористости.
На практике вредное влияние газовых примесей подавляется путем очистки расплава от водорода (обычно продувкой инертными газами или хлором) и путем его фильтрования с целью удаления оксидных частиц.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Нерастворимые примеси в алюминии
Отрицательное влияние примесей с низкой растворимостью связано с образованием фаз и/или эвтектик с низкой температурой плавления. Частицы фаз, не растворимые при гомогенизирующем отжиге, имеют обычно низкую пластичность и часто вытянутую форму. Такие частицы значительно снижают технологическую пластичность, относительное удлинение и прочность алюминиевого сплава. Кроме того, необходимо учитывать возможность соединения основных легирующих элементов в нерастворимые фазы. Такие фазы могут приводить к снижению, например, эффекта упрочнения старением.
Нерастворимые фазы часто имеют электродный потенциал, сильно отличающийся от потенциала алюминиевой матрицы, что снижает коррозионную стойкость сплава. С другой стороны, низкорастворимые металлы почти не влияют на электрическую проводимость, что дает возможность применять их как легирующие добавки в электротехнических сплавах: марках алюминия и алюминиевых сплавах.
Строение атома
Алюминий – это 13 элемент периодической таблицы. Он находится в третьем периоде, III группе, главной подгруппе.
Свойства и применение алюминия связаны с его электронным строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, располагающихся на трёх энергетических уровнях. Электронная конфигурация атома – 1s22s22p63s23p1.
На внешнем энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.
Рис. 1. Строение атома алюминия.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Снижение вредного влияния примесей в алюминии
Однако технологические операции не всегда способны снизить содержание примесей до приемлемого уровня, а в некоторых случаях они просто экономически не эффективны. Например, стоимость алюминия после зонного рафинирования может быть в несколько раз больше, чем первичный электролитический алюминий. Альтернативным путем является контроль над примесями путем дополнительного легирования и термической обработки. Специальное легирование изменяет фазовый состав, свойства и морфологию избыточных фаз, а термическая обработка может приводить к растворению, фрагментации и коагуляции частиц с неблагоприятной морфологией.
История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла – алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Читать также: Как определить площадь поперечного сечения
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.
Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл – один из самых популярных и применяемых в строительстве и бытовой промышленности.
Эвтектика железа с алюминием
Железо является переходным металлом, который образует с алюминием эвтектику и имеет очень низкую растворимость в твердом алюминии. Железо,в отличии от таких переходных металлов как марганец, хром, цирконий, титан и скандий, не имеет тенденции образовывать твердый раствор. Причем твердый раствор не образуется не только при промышленных скоростях охлаждения (до 1000 К/с), но даже и при быстром затвердевании при скоростях порядка 1000000 К/с. Более того, фазы, которые образует железо, имеют параметры решетки и структуры, не такие как у алюминия. Поэтому железо не применяют в качестве измельчителя зерна или замедлителя рекристаллизации алюминиевых сплавов.
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде — кислород:
2Al2O3 → 4Al + 3O2
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C — проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
В начало страницы
Фазовая диаграмма алюминий-железо
Для анализа алюминиевых сплавов, в которых железо является примесью или легирующим элементом, незаменимым инструментом является диаграмма состояния (или фазовая диаграмма) железо-алюминий.
Рисунок — «Алюминиевый» край фазовой диаграммы алюминий-железо
Сплавы богатые алюминием характеризуются эвтектическим взаимодействием твердого раствора алюминия и фазы Al3Fe:
L –> Al + Al3Fe.
Эвтектическая реакция происходит при 652-655 ºС при концентрации железа в эвтектической точке 1,8 %.
Фаза Al3Fe (40,7 % Fe) занимает обширную гомогенную область от 37,3 до 40,7 %. Фаза Al5Fe2 имеет концентрацию железа 27,5-29 % Fe.