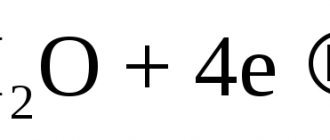процесс добычи руды
Гидрометаллургия
это техника в области добывающая металлургия, получение металлов из их руд. Гидрометаллургия предполагает использование водный решения для извлечения металлов из руд, концентратов и вторичных или остаточных материалов.[1][2] Технологии, дополняющие гидрометаллургию: пирометаллургия, паровая металлургия и электрометаллургия расплавов солей. Гидрометаллургия обычно делится на три основных направления:
- Выщелачивание
- Концентрация и очистка раствора
- Восстановление металлов или металлических соединений
Выщелачивание
Выщелачивание включает использование водных растворов для извлечения металла из металлосодержащих материалов, который контактирует с материалом, содержащим ценный металл.[3] Первые образцы происходят из Германии и Испании 17 века, где его применяли для добычи меди.[4]
В выщелачивающий Условия раствора меняются с точки зрения pH, окислительно-восстановительного потенциала, присутствия хелатирующих агентов и температуры, чтобы оптимизировать скорость, степень и селективность растворения желаемого металлического компонента в водной фазе. За счет использования хелатирующие агентыможно выборочно извлекать определенные металлы. Такие хелатирующие агенты обычно представляют собой амины базы шиффа.[5]
Пять основных конфигураций реактора выщелачивания: на месте, в куче, чане, резервуаре и автоклаве.
Выщелачивание на месте
Выщелачивание на месте также называется «добычей решений». Первоначально этот процесс включает бурение скважин в залежи руды. Взрывчатые вещества или гидроразрыв используются для создания открытых путей внутри отложения для проникновения раствора. Раствор для выщелачивания закачивается в залежь, где он контактирует с рудой. Затем раствор собирается и обрабатывается. В Урановое месторождение Беверли является примером выщелачивания на месте, а также троянской шахтой в Зимбабве.[нужна цитата
]
Кучное выщелачивание
В процессах кучного выщелачивания дробленая (а иногда и агломерированная) руда складывается в кучу, покрытую непроницаемым слоем. Выщелачивающий раствор распыляется поверх кучи, и ему дают просачиваться вниз через кучу. Конструкция отвала обычно включает в себя отстойники, которые позволяют перекачивать «насыщенный» выщелачивающий раствор (т.е. раствор с растворенными ценными металлами) для дальнейшей обработки. Примером является цианирование золота, где пылевидные руды извлекаются раствором цианид натрия, который в присутствии воздуха растворяет золото, оставляя недрагоценный осадок.
Шариковая модель комплексного аниона ауроцианида или дицианоаурата (I), [Au (CN)2]−.[6]
Выщелачивание НДС
Выщелачивание НДС включает контактирование материала, который обычно подвергается измельчению и классификации, с выщелачивающим раствором в больших чанах.
Выщелачивание резервуаров
Бак с мешалкой, также называемое выщелачиванием с перемешиванием, включает контактирование материала, который обычно подвергается измельчению и классификации, с выщелачивающим раствором в резервуарах с мешалкой. Перемешивание может улучшить кинетику реакции за счет увеличения массопереноса. Резервуары часто имеют последовательную конфигурацию реакторов.
Выщелачивание в автоклаве
Автоклав реакторы используются для реакций при более высоких температурах, что может увеличить скорость реакции. Точно так же автоклавирование позволяет использовать в системе газообразные реагенты.
Щелочные металлы
Массовое получение щелочных металлов – более сложный процесс. Это обусловлено тем, что они встречаются в природе только в виде химических соединений. Поскольку они являются восстановителями, их получение сопровождается высокими энергетическими затратами. Существует несколько способов добывания щелочных металлов:
• Литий можно получить из его оксида в вакууме или путем электролиза расплава его хлорида, образующегося при переработке сподумена.
• Натрий добывают путем прокаливания соды с углем в плотно закрытых тиглях или электролизом расплава хлорида с добавлением кальция. Первый способ наиболее трудоемкий.
• Калий получают электролизом расплава его солей либо, пропуская пары натрия через его хлорид. Также он образуется при взаимодействии расплавленного гидроксида калия и жидкого натрия при температуре 440°С.
• Цезий и рубидий добывают при помощи восстановления их хлоридов кальцием при 700–800 °С или цирконием при 650 °С. Получение щелочных металлов таким способом является крайне энергоемким и дорогостоящим.
Концентрация и очистка раствора
После выщелачивания щелок от выщелачивания обычно должен подвергаться концентрации ионов металлов, которые должны быть извлечены. Кроме того, иногда требуется удаление нежелательных ионов металлов.[1]
- Осадки это селективное удаление соединения целевого металла или удаление основной примеси путем осаждения одного из его соединений. Медь осаждается в виде сульфида для очистки продуктов выщелачивания никеля.
- Цементация представляет собой превращение иона металла в металл за счет окислительно-восстановительная реакция. Типичное применение включает добавление металлолома к раствору ионов меди. Железо растворяется и осаждается металлическая медь.
- Экстракция растворителем
- Ионный обмен
- Редукция газа. Обработка раствора никеля и аммиака водородом дает металлический никель в виде порошка.
- Электровиннинг особенно избирательно, если дорого электролиз процесс, применяемый для выделения драгоценных металлов. Золото можно гальванизировать из его растворов.
Экстракция растворителем
в экстракция растворителем представляет собой смесь экстрагент в разбавитель используется для извлечения металла из одной фазы в другую. При экстракции растворителем эту смесь часто называют «органической», потому что основным компонентом (разбавителем) является какой-то тип масла.
PLS (насыщенный выщелачивающий раствор) смешивают до эмульгирования с удаленным органическим веществом и дают ему разделиться.[нужна цитата
] Металл будет заменен PLS на органический, который они модифицировали.[
требуется разъяснение
] Результирующие потоки будут загруженными органическими и рафинат. При электролитическом выделении загруженные органические вещества затем смешивают до эмульгирования с обедненным электролитом и дают ему разделиться. Металл будет заменен органикой на электролит. Получающиеся потоки будут представлять собой очищенный от органики и богатый электролит. Органический поток рециркулирует через процесс экстракции растворителем в то время как водные потоки проходят цикл выщелачивания и электрохимического извлечения[
требуется разъяснение
] процессы соответственно.[
нужна цитата
]
Ионный обмен
Хелатирование агенты, натуральные цеолит, активированный уголь, смолы и жидкие органические вещества, пропитанные хелатирующими агентами, используются для обмена катионы или же анионы с раствором.[нужна цитата
] Селективность и извлечение зависят от используемых реагентов и присутствующих загрязнителей.
Лекция № 9. Роль и значение гидрометаллургических процессов
Гидрометаллургическими называются процессы извлечения металлов из руд, концентратов, промежуточных продуктов и отходов металлургического производства, а также из вторичного сырья в водную фазу при их обработке водными растворами химических реагентов с последующим выделением из растворов металлов или их соединений.
Как известно, комплексность использования минерального сырья определяет эффективность и целесообразность промышленного производства в целом. Повышение степени извлечения компонентов из рудного и техногенного сырья в готовые продукты – одна из основных задач металлургии.
Рудное сырье содержит различные металлы. Повышение эффективности использования сырья ставит задачу извлечения всех составляющих, содержащихся в нем. В то же время содержание даже основного компонента в рудах цветных металлов редко превышает 1 %, а зачастую даже ниже. Таким образом, даже при относительно полном извлечении основных металлов используется только незначительная часть добываемого сырья, при этом без пользы извлекается из недр, дробится, измельчается огромное количество руды.
Руды, как правило, представляют собой многокомпонентное комплексное сырье, содержащее кроме основных металлов ряд сопутствующих элементов, извлечение которых отвечает требованиям комплексности использования сырья. Не менее важным является то, что с развитием современной техники и технологии все большее потребление находят редкие, редкоземельные и рассеянные металлы, содержание в рудах которых зачастую находится на уровне сотых и тысячных долей процента. Применительно к большой группе металлов, не имеющих собственных руд (галлий, гафний, германий, рений, осмий и т.д.), попутное извлечение их при переработке руд других металлов – единственно возможный путь.
Серьезной проблемой современной металлургии является превращение производства цветных металлов в безотходное или малоотходное. Проблема отходов непосредственно связана с более полным использованием всех компонентов минерального сырья. Неиспользуемые компоненты сырья неизбежно требуют больших затрат для их обезвреживания и складирования или захоронения. Даже в виде обезвреженных продуктов отходы металлургического производства наносят ущерб окружающей среде, так как требуют значительных территорий для размещения и систематического контроля за их поведением под воздействием внешних условий.
Таким образом, современные технологии должны отвечать требованиям охраны окружающей среды, не являться источником вредных выделений и не оказывать негативного воздействия на экосистему. Эти условия особенно актуальны в настоящее время, когда уровень загрязнения окружающей среды в районах расположения металлургических предприятий приближается к критическому.
Выше описанные проблемы в определенной мере решаются при использовании гидрометаллургических приемов переработки сырья. Пирометаллургические процессы создают значительно большую нагрузку за счет значительного энергопотребления (и выделения энергии в окружающую среду), пылевыноса и выделения реакционных газов. Это предопределяет расширение сферы использования гидрометаллургических процессов в цветной металлургии благодаря следующим основным преимуществам:
1) возможность эффективной переработки бедного и сложного по составу металлургического сырья; богатые руды постепенно вырабатываются, и в металлургическую переработку вовлекаются все более бедные, сложные по составу, труднообогатимые руды, не пригодные для пирометаллургической переработки;
2) в связи с низкими энергозатратами гидрометаллургические процессы более привлекательны, чем пирометаллургические;
3) социальный эффект — осуществление процессов не требует высоких температур, отсутствует пылевынос, что обеспечивает более комфортные условия труда;
4) гидрометаллургические процессы гораздо легче могут быть механизированы и автоматизированы, чем пирометаллургические;
5) несмотря на значительную коррозию аппаратуры при гидрометаллургических процессах, затраты на футеровку при проведении процессов плавки выше;
6) экологический эффект – сокращаются, а в некоторых случаях и устраняются выбросы продуктов реакций в атмосферу.
В современной металлургии гидрометаллургические процессы широко используются при производстве многих металлов: цинка, меди, никеля, кобальта, алюминия, золота, серебра, платиновых металлов, урана и других радиоактивных металлов, вольфрама, молибдена, тантала, ниобия, ванадия, бериллия, редкоземельных и многих других металлов. Благодаря разработке и широкому внедрению в последние годы новых сорбционных и экстракционных методов извлечения, концентрирования и разделения металлов, развитию бесфильтрационных процессов, процессов автоклавной переработки, процессов осаждения и выделения металлов из растворов газами и др., эффективность и области применения гидрометаллургических процессов постоянно возрастают.
Основные виды процессов и операций в гидрометаллургии
В зависимости от типа перерабатываемого сырья, свойств металлов и их соединений, цели процесса в гидрометаллургической практике используются различные подготовительные и основные процессы и операции. Остановимся на основных.
1) Подготовка рудного сырья к выщелачиванию. К подготовительным операциям относятся:
− механическая обработка рудного сырья (дробление, измельчение, классификация) с целью вскрытия ценных минералов и создания большой удельной поверхности выщелачиваемой твердой фазы;
− агломерация тонкодисперсных материалов с целью укрупнения и получения частиц с пористой структурой;
− обработка исходного материала с изменением химического состава сырья с целью получения более пригодных для гидрометаллургической переработки соединений.
Механическая обработка и агломерация не ставят целью изменение химического состава материалов. Для направленного изменения химического состава и свойств сырья применяется окислительный, хлорирующий, сульфатизирующий и другие виды обжига. Кроме обжига находит применение спекание с солями и щелочными реагентами.
2) Выщелачивание – извлечение растворимого компонента из твердой фазы в водный раствор.
3) Разделение твердой и жидкой фаз (операции отстаивания, декантации, сгущения и фильтрации).
4) Подготовка растворов к выделению из них металлов или чистых соединений:
− очистка растворов от примесей (рафинирование);
− концентрирование раствора по извлекаемому компоненту (упаривание, применение процессов ионного обмена или жидкостной экстракции).
5) Выделение из растворов металлов или их соединений (цементация, осаждение труднорастворимых соединений, электролиз и т.д.).
Цель и задачи выщелачивания.
Выщелачиванием называется процесс избирательного извлечения одного или нескольких компонентов из руд, концентратов или промежуточных продуктов металлургической переработки в водный раствор с целью отделения их от пустой породы.
Избирательность достигается соответствующим подбором реагентов и созданием условий (концентрация реагентов, температура и т.п.), при которых скорости выщелачивания отдельных компонентов значительно различаются.
Выбор растворителя для выщелачивания зависит от следующих основных факторов:
− химическая и физическая природа подлежащего выщелачиванию материала;
− стоимость растворителя;
− коррозионное воздействие растворителя на аппаратуру;
− селективность действия растворителя по отношению к выщелачиваемому материалу;
− возможность регенерации растворителя.
Правильный выбор растворителя чрезвычайно важен. Замена одного растворителя другим, более удачным, означает по существу революционные изменения в той или иной области гидрометаллургии. Примером может служить введение цианида натрия в практику выщелачивания золотых и серебряных руд.
Рассмотрим наиболее распространенные растворители, применяемые в гидрометаллургической практике.
Вода.
Вода используется для выщелачивания хорошо растворимых природных и техногенных соединений – сульфатов, хлоридов. Водорастворимые соединения могут быть получены в результате сульфатизирующего или хлорирующего обжига. Сульфаты металлов могут быть получены и в результате автоклавного окисления сульфидов под давлением кислорода. Растворяются в воде и некоторые оксиды с образование кислот или щелочей. Например:
Re2O7 + H2O ® 2HReO4, (9.1)
As2O5 + H2O ® 2HAsO3, (9.2)
Na2O + H2O ® 2NaOH. (9.3)
Кислоты.
Серная кислота – один из наиболее важных и широко распространенных растворителей, применяемых при выщелачивании. Являясь хорошим растворителем при выщелачивании широкого спектра соединений, она менее агрессивна по отношению к аппаратуре, доступна и дешевле, чем соляная и азотная кислоты, Кроме того, разработаны надежные методы коррозионной защиты от серной кислоты. При выщелачивании используется как разбавленная, так и концентрированная серная кислота. В некоторых случаях используется смесь серной кислоты с другими кислотами (например, плавиковой, соляной). Если допускает технология, то в качестве серной кислоты применяют отработанные кислые электролиты, получаемые при электролитическом осаждении металлов (меди, цинка и др.) из растворов после соответствующей корректировки растворов. Разбавленной серной кислотой хорошо выщелачиваются окисленные соединения меди и цинка. Например:
CuCO3*Cu(OH)2 + 2H2SO4 ® 2CuSO4 + CO2 + 3H2O, (9.4)
ZnO + H2SO4 ® ZnSO4 + H2O. (9.5)
В результате недостаточной селективности процесса при выщелачивании серной кислотой соединений цветных металлов могут растворяться также и окисленные соединения железа, повышая расход кислоты и загрязняя растворы, например, по реакции:
Fe2O3 + 3 H2SO4 ® Fe2(SO4) 3 + 3H2O. (9.6)
При понижении кислотности раствора железо осаждается гидролитически с одновременным выделением серной кислоты:
Fe2(SO4) 3 + 6H2O ® 2Fe(OH) 3 + 3 H2SO4. (9.7)
Серная кислота широко используется при выщелачивании урана. Минералы титана растворяются только в концентрированных кислотах, и, будучи растворенными, они гидролизуют при понижении кислотности. Ряд упорных окисленных соединений, таких как минералы циркония, ниобия, тантала, кремния, в серной кислоте не растворяются.
Соляную и азотную кислоты в практике гидрометаллургии используют ограниченно.
Смесь соляной и азотной кислот («царская водка») используют для выщелачивания платиновых руд, а также при рафинировании золота и серебра.
Водные растворы щелочей и оснований.
Для выщелачивания алюминия из бокситов, вольфрамитовых и шеелитовых руд и концентратов используются растворы гидроксида натрия. Выщелачивание щелочами имеет следующие преимущества по сравнению с выщелачиванием кислотами:
− возможность выщелачивания руд с высоким содержанием карбонатов (CaCO3);
− более высокую по отношению к серной кислоте селективность (например, вследствие химической инертности оксидов железа по отношению к щелочам);
− незначительную коррозию аппаратуры.
Гидроксид аммония применяется при выщелачивании металлов, которые образуют хорошо растворимые комплексные соединения – аммиакаты (например, медь и никель).
Водные растворы солей.
Растворы солей применяют для процессов обменного и окислительного выщелачивания, а также при выщелачивании с образованием комплексных соединений. Сульфат железа (III) используют для окислительного выщелачивания сульфидных минералов:
CuS + Fe2(SO4) 3 ® CuSO4 + 2FeSO4 + S0. (9.8)
Образующуюся в результате реакции соль железа (II) можно окислить кислородом и вновь использовать для выщелачивания:
2FeSO4 + H2SO4 + 0,5O2 ® Fe2(SO4) 3 + H2O. (9.9)
Углекислый натрий применяют при выщелачивании урановых руд:
UO2 + 3 Na2CO3 + H2O + 0.5O2 ® Na4[UO2(CO3) 3]+ 2NaOH. (9.10)
Хлорид натрия используют для выщелачивания минералов свинца с образованием комплексного соединения:
PbSO4 +4NaCl ® Na2SO4 + Na2[PbCl4]. (9.11)
Цианид натрия применяют для выщелачивания золота и серебра. Процесс идет с образованием комплексного соединения:
2Au + 4NaCN +0.5O2 +H2O ® 2Na[Au(CN) 2] + 2NaOH (9.12)
Сернистый натрий используют для выщелачивания сульфидных минералов, образующих растворимые полисульфиды:
Sb2S3 + 3Na2S ® 2Na3[SbS3]. (9.13)
Гидрометаллургическими называются процессы извлечения металлов из руд, концентратов, промежуточных продуктов и отходов металлургического производства, а также из вторичного сырья в водную фазу при их обработке водными растворами химических реагентов с последующим выделением из растворов металлов или их соединений.
Как известно, комплексность использования минерального сырья определяет эффективность и целесообразность промышленного производства в целом. Повышение степени извлечения компонентов из рудного и техногенного сырья в готовые продукты – одна из основных задач металлургии.
Рудное сырье содержит различные металлы. Повышение эффективности использования сырья ставит задачу извлечения всех составляющих, содержащихся в нем. В то же время содержание даже основного компонента в рудах цветных металлов редко превышает 1 %, а зачастую даже ниже. Таким образом, даже при относительно полном извлечении основных металлов используется только незначительная часть добываемого сырья, при этом без пользы извлекается из недр, дробится, измельчается огромное количество руды.
Руды, как правило, представляют собой многокомпонентное комплексное сырье, содержащее кроме основных металлов ряд сопутствующих элементов, извлечение которых отвечает требованиям комплексности использования сырья. Не менее важным является то, что с развитием современной техники и технологии все большее потребление находят редкие, редкоземельные и рассеянные металлы, содержание в рудах которых зачастую находится на уровне сотых и тысячных долей процента. Применительно к большой группе металлов, не имеющих собственных руд (галлий, гафний, германий, рений, осмий и т.д.), попутное извлечение их при переработке руд других металлов – единственно возможный путь.
Серьезной проблемой современной металлургии является превращение производства цветных металлов в безотходное или малоотходное. Проблема отходов непосредственно связана с более полным использованием всех компонентов минерального сырья. Неиспользуемые компоненты сырья неизбежно требуют больших затрат для их обезвреживания и складирования или захоронения. Даже в виде обезвреженных продуктов отходы металлургического производства наносят ущерб окружающей среде, так как требуют значительных территорий для размещения и систематического контроля за их поведением под воздействием внешних условий.
Таким образом, современные технологии должны отвечать требованиям охраны окружающей среды, не являться источником вредных выделений и не оказывать негативного воздействия на экосистему. Эти условия особенно актуальны в настоящее время, когда уровень загрязнения окружающей среды в районах расположения металлургических предприятий приближается к критическому.
Выше описанные проблемы в определенной мере решаются при использовании гидрометаллургических приемов переработки сырья. Пирометаллургические процессы создают значительно большую нагрузку за счет значительного энергопотребления (и выделения энергии в окружающую среду), пылевыноса и выделения реакционных газов. Это предопределяет расширение сферы использования гидрометаллургических процессов в цветной металлургии благодаря следующим основным преимуществам:
1) возможность эффективной переработки бедного и сложного по составу металлургического сырья; богатые руды постепенно вырабатываются, и в металлургическую переработку вовлекаются все более бедные, сложные по составу, труднообогатимые руды, не пригодные для пирометаллургической переработки;
2) в связи с низкими энергозатратами гидрометаллургические процессы более привлекательны, чем пирометаллургические;
3) социальный эффект — осуществление процессов не требует высоких температур, отсутствует пылевынос, что обеспечивает более комфортные условия труда;
4) гидрометаллургические процессы гораздо легче могут быть механизированы и автоматизированы, чем пирометаллургические;
5) несмотря на значительную коррозию аппаратуры при гидрометаллургических процессах, затраты на футеровку при проведении процессов плавки выше;
6) экологический эффект – сокращаются, а в некоторых случаях и устраняются выбросы продуктов реакций в атмосферу.
В современной металлургии гидрометаллургические процессы широко используются при производстве многих металлов: цинка, меди, никеля, кобальта, алюминия, золота, серебра, платиновых металлов, урана и других радиоактивных металлов, вольфрама, молибдена, тантала, ниобия, ванадия, бериллия, редкоземельных и многих других металлов. Благодаря разработке и широкому внедрению в последние годы новых сорбционных и экстракционных методов извлечения, концентрирования и разделения металлов, развитию бесфильтрационных процессов, процессов автоклавной переработки, процессов осаждения и выделения металлов из растворов газами и др., эффективность и области применения гидрометаллургических процессов постоянно возрастают.
Основные виды процессов и операций в гидрометаллургии
В зависимости от типа перерабатываемого сырья, свойств металлов и их соединений, цели процесса в гидрометаллургической практике используются различные подготовительные и основные процессы и операции. Остановимся на основных.
1) Подготовка рудного сырья к выщелачиванию. К подготовительным операциям относятся:
− механическая обработка рудного сырья (дробление, измельчение, классификация) с целью вскрытия ценных минералов и создания большой удельной поверхности выщелачиваемой твердой фазы;
− агломерация тонкодисперсных материалов с целью укрупнения и получения частиц с пористой структурой;
− обработка исходного материала с изменением химического состава сырья с целью получения более пригодных для гидрометаллургической переработки соединений.
Механическая обработка и агломерация не ставят целью изменение химического состава материалов. Для направленного изменения химического состава и свойств сырья применяется окислительный, хлорирующий, сульфатизирующий и другие виды обжига. Кроме обжига находит применение спекание с солями и щелочными реагентами.
2) Выщелачивание – извлечение растворимого компонента из твердой фазы в водный раствор.
3) Разделение твердой и жидкой фаз (операции отстаивания, декантации, сгущения и фильтрации).
4) Подготовка растворов к выделению из них металлов или чистых соединений:
− очистка растворов от примесей (рафинирование);
− концентрирование раствора по извлекаемому компоненту (упаривание, применение процессов ионного обмена или жидкостной экстракции).
5) Выделение из растворов металлов или их соединений (цементация, осаждение труднорастворимых соединений, электролиз и т.д.).
Цель и задачи выщелачивания.
Выщелачиванием называется процесс избирательного извлечения одного или нескольких компонентов из руд, концентратов или промежуточных продуктов металлургической переработки в водный раствор с целью отделения их от пустой породы.
Избирательность достигается соответствующим подбором реагентов и созданием условий (концентрация реагентов, температура и т.п.), при которых скорости выщелачивания отдельных компонентов значительно различаются.
Выбор растворителя для выщелачивания зависит от следующих основных факторов:
− химическая и физическая природа подлежащего выщелачиванию материала;
− стоимость растворителя;
− коррозионное воздействие растворителя на аппаратуру;
− селективность действия растворителя по отношению к выщелачиваемому материалу;
− возможность регенерации растворителя.
Правильный выбор растворителя чрезвычайно важен. Замена одного растворителя другим, более удачным, означает по существу революционные изменения в той или иной области гидрометаллургии. Примером может служить введение цианида натрия в практику выщелачивания золотых и серебряных руд.
Рассмотрим наиболее распространенные растворители, применяемые в гидрометаллургической практике.
Вода.
Вода используется для выщелачивания хорошо растворимых природных и техногенных соединений – сульфатов, хлоридов. Водорастворимые соединения могут быть получены в результате сульфатизирующего или хлорирующего обжига. Сульфаты металлов могут быть получены и в результате автоклавного окисления сульфидов под давлением кислорода. Растворяются в воде и некоторые оксиды с образование кислот или щелочей. Например:
Re2O7 + H2O ® 2HReO4, (9.1)
As2O5 + H2O ® 2HAsO3, (9.2)
Na2O + H2O ® 2NaOH. (9.3)
Кислоты.
Серная кислота – один из наиболее важных и широко распространенных растворителей, применяемых при выщелачивании. Являясь хорошим растворителем при выщелачивании широкого спектра соединений, она менее агрессивна по отношению к аппаратуре, доступна и дешевле, чем соляная и азотная кислоты, Кроме того, разработаны надежные методы коррозионной защиты от серной кислоты. При выщелачивании используется как разбавленная, так и концентрированная серная кислота. В некоторых случаях используется смесь серной кислоты с другими кислотами (например, плавиковой, соляной). Если допускает технология, то в качестве серной кислоты применяют отработанные кислые электролиты, получаемые при электролитическом осаждении металлов (меди, цинка и др.) из растворов после соответствующей корректировки растворов. Разбавленной серной кислотой хорошо выщелачиваются окисленные соединения меди и цинка. Например:
CuCO3*Cu(OH)2 + 2H2SO4 ® 2CuSO4 + CO2 + 3H2O, (9.4)
ZnO + H2SO4 ® ZnSO4 + H2O. (9.5)
В результате недостаточной селективности процесса при выщелачивании серной кислотой соединений цветных металлов могут растворяться также и окисленные соединения железа, повышая расход кислоты и загрязняя растворы, например, по реакции:
Fe2O3 + 3 H2SO4 ® Fe2(SO4) 3 + 3H2O. (9.6)
При понижении кислотности раствора железо осаждается гидролитически с одновременным выделением серной кислоты:
Fe2(SO4) 3 + 6H2O ® 2Fe(OH) 3 + 3 H2SO4. (9.7)
Серная кислота широко используется при выщелачивании урана. Минералы титана растворяются только в концентрированных кислотах, и, будучи растворенными, они гидролизуют при понижении кислотности. Ряд упорных окисленных соединений, таких как минералы циркония, ниобия, тантала, кремния, в серной кислоте не растворяются.
Соляную и азотную кислоты в практике гидрометаллургии используют ограниченно.
Смесь соляной и азотной кислот («царская водка») используют для выщелачивания платиновых руд, а также при рафинировании золота и серебра.
Водные растворы щелочей и оснований.
Для выщелачивания алюминия из бокситов, вольфрамитовых и шеелитовых руд и концентратов используются растворы гидроксида натрия. Выщелачивание щелочами имеет следующие преимущества по сравнению с выщелачиванием кислотами:
− возможность выщелачивания руд с высоким содержанием карбонатов (CaCO3);
− более высокую по отношению к серной кислоте селективность (например, вследствие химической инертности оксидов железа по отношению к щелочам);
− незначительную коррозию аппаратуры.
Гидроксид аммония применяется при выщелачивании металлов, которые образуют хорошо растворимые комплексные соединения – аммиакаты (например, медь и никель).
Водные растворы солей.
Растворы солей применяют для процессов обменного и окислительного выщелачивания, а также при выщелачивании с образованием комплексных соединений. Сульфат железа (III) используют для окислительного выщелачивания сульфидных минералов:
CuS + Fe2(SO4) 3 ® CuSO4 + 2FeSO4 + S0. (9.8)
Образующуюся в результате реакции соль железа (II) можно окислить кислородом и вновь использовать для выщелачивания:
2FeSO4 + H2SO4 + 0,5O2 ® Fe2(SO4) 3 + H2O. (9.9)
Углекислый натрий применяют при выщелачивании урановых руд:
UO2 + 3 Na2CO3 + H2O + 0.5O2 ® Na4[UO2(CO3) 3]+ 2NaOH. (9.10)
Хлорид натрия используют для выщелачивания минералов свинца с образованием комплексного соединения:
PbSO4 +4NaCl ® Na2SO4 + Na2[PbCl4]. (9.11)
Цианид натрия применяют для выщелачивания золота и серебра. Процесс идет с образованием комплексного соединения:
2Au + 4NaCN +0.5O2 +H2O ® 2Na[Au(CN) 2] + 2NaOH (9.12)
Сернистый натрий используют для выщелачивания сульфидных минералов, образующих растворимые полисульфиды:
Sb2S3 + 3Na2S ® 2Na3[SbS3]. (9.13)
Восстановление металлов
Восстановление металла — это заключительный этап гидрометаллургического процесса. Металлы, подходящие для продажи в качестве сырья, часто производятся непосредственно на стадии извлечения металла. Однако иногда требуется дальнейшее рафинирование, если нужно получить металлы сверхвысокой чистоты. Основными типами процессов восстановления металлов являются электролиз, газовое восстановление и осаждение. Например, главной целью гидрометаллургии является медь, которую обычно получают электролизом. Cu2+ ионы уменьшаются при умеренном потенциале, оставляя после себя другие загрязняющие металлы, такие как Fe2+ и Zn2+.
Электролиз
Электровиннинг и электрорафинирование, соответственно, включают извлечение и очистку металлов с использованием электроосаждение металлов на катоде, либо металл растворение или конкурирующий реакция окисления на аноде.
Осадки
Осаждение в гидрометаллургии включает химическое осаждение либо металлов и их соединений, либо загрязняющих веществ из водных растворов. Осадки продолжится, когда через реагент добавление, испарение, изменение pH или температурные манипуляции, любой конкретный вид превышает предел его растворимости.
Общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами
.
Получение металлов из руд — задача металлургии.
Металлургия
— это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
М n+ + ne−→M
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
В соответствии с этим существуют следующие способы получения металлов:
• пирометаллургический;
• гидрометаллургический;
• электрометаллургический.
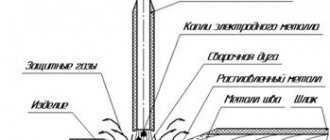
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
1) МоO3 + ЗН2 = Мо + ЗН2O (водородотермия)
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
ЗМnO2 + 4Аl = ЗМn + 2Аl2O3 (алюминотермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
Q= Σ Q1 — Σ Q 2 ,
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C 2CO3Fe2O3 + CO = 2(Fe2Fe32)O4+ CO2(Fe2Fe32)O4+ CO= 3FeO + CO2FeO + CO= Fe + CO2(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали
(0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева.
Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов.
При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
СuО + Н2SО4 = СuSO4 + Н2
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
СuSO4. + Fе = Сu + FеSO4
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия
— восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
Примеры:а) NaCl (электролиз расплава) → 2Na + Cl2
Рекомендации
- ^ аб
Брент Хиски «Металлургия, обзор» в Энциклопедии химической технологии Кирк-Отмера, 2000, Wiley-VCH, Weinheim. Дои:10.1002 / 0471238961.1921182208091911.a01 - Ф. Хабаши «Последние тенденции в добывающей металлургии» Горный и металлургический журнал, Раздел B: Металлургия, 2009 г., Том 45, стр. 1-13. Дои:10.2298 / JMMB0901001H
- Гм, Намил (июль 2022 г.). Гидрометаллургический процесс извлечения редкоземельных элементов из отходов: основное применение кислотного выщелачивания с разработанной схемой
. ИНТЕК. С. 41–60. ISBN 978-953-51-3402-2 . - Хабаши, Фатхи (2005). «Краткая история гидрометаллургии». Гидрометаллургия
.
79
(1–2): 15–22. Дои:10.1016 / j.hydromet.2004.01.008. - Таскер, Питер А .; Тонг, Кристин С.; Вестра, Арьян Н. (2007). «Совместное извлечение катионов и анионов при извлечении цветных металлов». Обзоры координационной химии
.
251
(13–14): 1868–1877. Дои:10.1016 / j.ccr.2007.03.014. - Greenwood, N. N .; И Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
Способы получения металлов
В зависимости от того, кокой восстановитель используют в металлургическом процессе различают: пиро – , гидро, электро – и биометаллургию.
Наиболее распространенные способы получения металлов: пирометаллургический и электрометаллургический. Большинство реакций восстановления протекают при высоких температурах (Рис. 2). Так как металлическая связь обладает повышенной прочностью, то выделение металлов в чистом виде из природных соединений проводят при высоких температурах.
Рис. 2. Металлургическое производство