Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала. К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.
Карбонат кальция
Считается, что наиболее важным химическим качеством является податливость к разложению при воздействии воды.
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
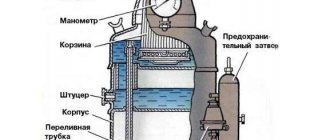
Опыт 1. Получение ацетилена и его горение.
⇐ ПредыдущаяСтр 5 из 8Следующая ⇒
Реактивы и материалы: карбид кальция СаС2 (в кусочках). Оборудование: газоотводная трубка с оттянутым концом.
Работу с ацетиленом необходимо проводить в вытяжном шкафу, так как неочищенный ацетилен, полученный из карбида кальция, содержит вредные, неприятно пахнущие примеси.
В пробирку помещают маленький кусочек карбида кальция СаС2, добавляют 2 капли воды и закрывают пробирку пробкой с газоотводной трубкой, имеющей оттянутый конец. В пробирке бурно выделяется газообразный ацетилен.
Химизм процесса:
СаС2 + 2Н2О → НС≡СН + Са(ОН)2
Поджигают ацетилен у конца газоотводной трубки. Он горит светящимся, коптящим пламенем. Реакция взаимодействия карбида кальция с водой экзотермична.
Ацетилен, полученный из карбида кальция, содержит незначительные количества NH3, РН3, АsН3 и других примесей и поэтому имеет характерный запах. Примеси можно удалить промыванием ацетилена водным раствором дихромата калия, подкисленного серной кислотой.
Опыт 2. Присоединение к ацетилену брома.
Реактивы и материалы: ацетилен; бромная вода, насыщенный раствор. Оборудование: газоотводная трубка.
Добавляют в пробирку с карбидом кальция (см. опыт 1) еще 2 капли воды и закрывают ее пробкой с газоотводной трубкой, коней которой опускают в пробирку с 5 каплями бромной воды. Бромная вода обесцвечивается вследствие присоединения атомов брома по месту тройной связи.
Химизм процесса:
НС≡СН + 2Вr2 → CHBr2–СНВr2
1,1,2,2-тетрабромэтан
Опыт 3. Отношение ацетилена к окислителям.
Реактивы и материалы: ацетилен; перманганат калия, 0,1 н. раствор. Оборудование: газоотводная трубка.
В пробирку помещают 1 каплю перманганата калия и 4 капли воды. В пробирку с кусочками карбида кальция добавляют еще 2 капли воды и закрывают пробкой с газоотводной трубкой, конец которой опускают в приготовленный раствор перманганата калия.
Розовый раствор быстро обесцвечивается: происходит окисление ацетилена по месту разрыва тройной связи с образованием промежуточного продукта окисления – щавелевой кислоты, которая окисляется дальше до диоксида углерода:
[O]
НС≡СН + 4[O] → HO – C – C – OH → 2CO2 + H2O
|| ||
O O
щавелевая кислота
Обесцвечивание бромной воды и раствора перманганата калия доказывает непредельность ацетилена.
Опыт 4. Образование ацетиленида серебра.
Реактивы и материалы: ацетилен; нитрат серебра, 0,2 н. раствор; аммиак, концентрированный раствор.
В пробирку вносят 2 капли раствора нитрата серебра и прибавляют 1 каплю раствора аммиака – образуется осадок гидроксида серебра. При добавлении 1-2 капель раствора аммиака осадок AgOH легко растворяется с образованием аммиачного раствора оксида серебра ([Ag(NH3)2]OH).
Через аммиачный раствор оксида серебра пропускают ацетилен (см. опыт 1). В пробирке образуется светло-желтый осадок ацетиленида серебра, который затем становится серым.
Химизм процесса:
НС≡СН + 2[Ag(NH3)2]ОН → AgС≡СAg↓ + 4NH3+ 2Н2О
Опыт 5. Образование ацетиленида меди.
Реактивы и материалы: карбид кальция; хлорид меди CuCl2, аммиачный раствор. Оборудование: фильтровальная бумага (полоски размером 5*40 мм).
В сухую пробирку помещают 1-2 кусочка карбида кальция и добавляют 2 капли воды. В отверстие пробирки вводят полоску фильтровальной бумаги, смоченной аммиачным раствором хлорида меди CuCl2, содержащим комплексный аммиакат состава [Cu(NH3)2]C12. Появляется красно-бурое окрашивание вследствие образования ацетиленида меди.
В водных растворах ацетилениды серебра и меди устойчивы. В сухом состоянии при нагревании или при ударе они взрываются с большой силой.
Химизм процесса:
НС≡СН + 2[Cu(NH3)2]C1 → CuС≡СCu↓ + 2NH4Cl + 2NH3
Литература:
1. Аверина А.В., Снегирева А.Я. Лабораторный практикум по органической химии. М.: Высшая школа, 1980. – С. 31-33.
Лабораторная работа №5
Ароматические углеводороды.
Цель: экспериментальное получение и изучение свойств ароматических углеводородов.
⇐ Предыдущая5Следующая ⇒
Рекомендуемые страницы:
Как выглядит карбид?
Чтобы определить, где найти карбид на улице, нужно знать его физические свойства. Физически вещество является твердым, его цвет может быть темным, имея сероватый или коричневый оттенок. Цвет зависит от количества углерода. Также имеется специфический запах, который характеризует данное вещество.
По консистенции он твердый, но легко крошится, превращаясь в порошок. Если поднести спичку, то начнется горение с выделением углерода и разложением кальция. Правда, этого можно достичь при высоких температурах, например охотничьей спичкой.
Производство [ править ]
Карбид кальция производится промышленным способом в электродуговой печи из смеси извести и кокса при температуре около 2200 ° C (3990 ° F). [6] Это эндотермическая реакция, требующая 110 килокалорий (460 кДж) на моль [7] и высоких температур для удаления монооксида углерода. Этот метод не изменился с момента его изобретения в 1892 году:
CaO + 3 C → CaC 2 + CO
Высокая температура, необходимая для этой реакции, практически недостижима при традиционном сжигании, поэтому реакцию проводят в электродуговой печи с графитовыми электродами. Полученный карбидный продукт обычно содержит около 80% карбида кальция по весу. Карбид измельчается с образованием небольших комков размером от нескольких до 50 мм. Примеси концентрируются в более мелких фракциях. Содержание CaC 2 в продукте определяют путем измерения количества ацетилена, образующегося при гидролизе. Например, британские и немецкие стандарты содержания более крупных фракций составляют 295 л / кг и 300 л / кг соответственно (при давлении 101 кПа и температуре 20 ° C (68 ° F)). Примеси, присутствующие в карбиде, включают фосфид, который производит фосфин.при гидролизе. [8]
Эта реакция была важной частью промышленной революции в химии и стала возможной в Соединенных Штатах в результате огромного количества недорогой гидроэлектроэнергии, производимой на Ниагарском водопаде до начала 20-го века. [9]
Метод производства в электродуговой печи был открыт в 1892 году Т.Л. Уилсоном и независимо от него Х. Муассаном в том же году. [10] [11] [12] В Боснии и Герцеговине, в городе Яйце, австрийский промышленник доктор Йозеф Кранц и его
, преемником которой позже стала
«Электро-Босна»
, открыли крупнейший химический завод по производству карбида кальция в то время в Европе в 1899 году. Гидроэлектростанция на Пливедля электроснабжения завода построена река с установленной мощностью 8 МВт. Это была первая в своем роде электростанция в Юго-Восточной Европе, которая была введена в эксплуатацию 24 марта 1899 года [13].
Техника безопасности
При проведении различных химических реакций для производства материалов должна соблюдаться техника безопасности. Как ранее было отмечено, выделяемые вещества могут быть взрывоопасными. Техника безопасности при взаимодействии с различными химическими веществами заключается в следующем:
- Для хранения и обработки требуется герметичное место. В обычном гараже проводить работы не рекомендуется.
- Нельзя допускать огонь к самому сырью, а также образующимся газам.
- Даже мелкие частицы могут привести к поражению кожных покровов. Именно поэтому работа должна проводится в респираторе и защитной одежде.
- Генераторы ацетилена размещают исключительно в хорошо изолированных помещениях.
- Если сырье применялось при проведении сварочных работ, то следует образующийся шлак утилизировать в специальных местах.
- При перемещении металлических и иных емкостей они должны быть надежно закреплены, столкновение и падение не допускается. Это может привести к появлению искр, которые станут причиной взрыва вещества.
Горение карбида кальция
Вышеприведенная информация определяет то, что работы с рассматриваемым сырьем не рекомендуется проводить в гараже или домашней мастерской. Несоблюдении технологии, отсутствии требующего оснащения и многие другие причины могут привести к возникновению искры и воспламенению веществ.
Ссылки [ править ]
- https://materialsproject.org/materials/mp-1575/
- Массалимов, ИА; Киреева, М.С.; Сангалов, Ю. А. (2002). «Структура и свойства механоактивированного пероксида бария». Неорганические материалы
.
38
(4): 363. DOI : 10,1023 / A: 1015105922260 . S2CID 91881752 . - Информация о рейтинге опасности NFPA для обычных химических веществ . Северо-Восточный университет
- Patnaik, Pradyot (2003). Справочник неорганических химических соединений
. Макгроу-Хилл. ISBN 0-07-049439-8 . - Винколи, Джеффри Уэйн (25 ноября 1996 г.). Управление рисками для опасных химических веществ
. CRC Press. п. 429. ISBN. 978-1-56670-200-3 . - ^ абвг
Гринвуд, Норман Н .; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн . п. 298. ISBN 978-0-08-037941-8 . - Рассчитано на основе данных CRC Handbook of Chemistry and Physics
. - ^ ab
Карбид кальция , Бернхард Лангхаммер, Энциклопедия промышленной химии Ульмана, Wiley Interscience. (Требуется подписка) - Фриман, Гораций (1919). «Производство цианамида» . Химические новости и журнал физических наук
.
117
: 232. - Морхед, JT и де Chalmot, G. (1896). «Производство карбида кальция» . Журнал Американского химического общества
.
18
(4): 311–331. DOI : 10.1021 / ja02090a001 .CS1 maint: multiple names: authors list (link) - Муассан, Х. (1892). «Chimie Minérale — Description d’un nouveau four électrique» . Comptes rendus hebdomadaires des séances de l’Académie des Sciences
.
115
: 1031. - Ренуф, Эдвард (1899). «Использование ацетилена» . Ежемесячный научно-популярный журнал
: 335–347. - «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika» . old.kons.gov.ba
(на сербохорватском). КОНС . Проверено 15 марта 2022 . - ^ ab
Гринвуд, Норман Н .; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . - Дун, Я (23 января 2006 г.). «Неприятности в индустрии ПВХ» . Совет по развитию торговли Гонконга. Архивировано 28 декабря 2007 года.CS1 maint: bot: original URL status unknown (link)
- «Правительство принимает меры по сдерживанию развития сектора карбида кальция» . China Daily через BusyTrade.com. 2007-05-16. Архивировано 11 февраля 2007 года.CS1 maint: bot: original URL status unknown (link)
- Лаксон, Джейми; Шлаг, Стефан; Токи, Горо (декабрь 2004 г.). «Карбид кальция» . НИИ Консалтинг.
- «Спелеологическое оборудование и культура (из Энциклопедии Те Ара Новой Зеландии)» .
- Клеммер, Грегг (1987). Карбидные лампы американских горняков: Руководство для коллекционеров по освещению американских карбидных рудников
. Публикации Westernlore. - Абелес, FB и Gahagan, HE III (1968). «Поглощение: роль этилена, аналогов этилена, двуокиси углерода и кислорода» . Plant Physiol.43
(8): 1255–1258. DOI : 10.1104 / pp.43.8.1255 . PMC 1087003 . PMID 16656908 . CS1 maint: multiple names: authors list (link) - «Ставка на это. Ваше манго созревает с использованием карбида» . ДНК
. 2013-05-18 . Проверено 25 августа 2022 . - «Употребление искусственно созревших фруктов вредно» .
- «Carbidschieten wordt feest» (на голландском). Algemeen Dagblad . 2016-12-24.
- Сингх, Рандхир. «Определение содержания воды в почве — метод карбида кальция» . Портал гражданского строительства
. Проверено 7 сентября 2022 . - ASTM International. «ASTM D4944-18, Стандартный метод испытаний для определения содержания воды (влаги) в почве в полевых условиях с помощью измерителя давления газа карбида кальция» . ASTM International . Проверено 7 сентября 2022 .
- дю Буа, TME «Molehill Mayhem» . п. 21.
- «Как избавиться от дворовых кротов с помощью карбида» . mysunnylawn.com
.
Транспортировка и хранение
Порошок карбида кальция при воздействии влаги практически моментально разлагается. При этом образуется ацетилен, который при большой концентрации горюч и взрывоопасный. Именно поэтому нужно уделять довольно много внимания хранению карбида кальция, для чего часто применяют бидоны и специальные барабаны. К другим особенностям хранения отнесем следующие моменты:
- Выделяющийся ацетилен легче воздуха, поэтому скапливается вверху. Стоит учитывать, что он обладает наркотическими действиями, может самовоспламеняться.
- При производстве большого объема вещества особое внимание уделяется технике безопасности. Для фасовки применяются специальные упаковки.
- Для открытия упаковки следует использовать инструменты, которые не становятся причиной образования искр.
- Если вещество попадает на кожу или слизистую оболочку, то его нужно сразу удалить. При этом пострадавшая поверхность обрабатывается специальным кремом или другим защитно-заживляющим веществом.
- По установленным правилам, транспортировка может проводится исключительно при применении крытого транспортного средства. При этом проводить доставку по воздуху запрещается.
Контейнер для транспортировки
Установленные правила также запрещают хранить карбид кальция вместе с другими химическими веществами и источниками тепла. Это связано с тем, что образующиеся газы могут вступать в химическую реакцию с другими химическими веществами и возгораться.
Применение вещества
Кальция карбид активно применяется в промышленности. Он является катализатором в сфере синтеза органических соединений. С его помощью стало возможным синтезировать каучук за более низкую цену. Однако для этого вначале необходимо провести необходимые химические реакции для синтеза собственного карбида, а уже потом — каучука. Все больше химиков задаются вопросом о том, где найти карбид в природе, чтобы облегчить себе работу.
Карбид нашел свое применение в садоводстве. На его основе фермеры получают удобрение под названием цианид кальция. Применяется для улучшения роста корневой системы саженцев и взрослых растений.
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.