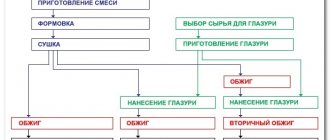
На свете известно очень много разных химических соединений: порядка сотни миллионов. И все они, как люди, индивидуальны. Нельзя найти два вещества, у которых совпадали бы химические и физические свойства при разном составе.
Одними из интереснейших неорганических веществ, существующих на белом свете, являются карбиды. В данной статье мы обсудим их строение, физические и химические свойства, применение и разберём тонкости их получения. Но для начала немного об истории открытия.
История
Карбиды металлов, формулы которых мы приведём ниже, не являются природными соединениями. Это обусловлено тем, что их молекулы склонны распадаться при взаимодействии с водой. Поэтому здесь стоит говорить о первых попытках синтеза карбидов.
Начиная с 1849 имеются упоминания о синтезе карбида кремния, однако некоторые из этих попыток остаются непризнанными. Крупномасштабное производство начал в 1893 году американский химик Эдвард Ачесон по способу, который был затем назван его именем.
История синтеза карбида кальция также не отличается большим количеством сведений. В 1862 году его получил немецкий химик Фридрих Вёлер, нагревая сплавленный цинк и кальций с углём.
Теперь перейдём к более интересным разделам: химическим и физическим свойствам. Ведь именно в них заключена вся суть применения данного класса веществ.
Физические свойства
Абсолютно все карбиды отличаются своей твёрдостью. Например, одним из самых твёрдых веществ по шкале Мооса является карбид вольфрама (9 из 10 возможных баллов). К тому же эти вещества очень тугоплавкие: температура плавления некоторых из них достигает двух тысяч градусов.
Большинство карбидов химически инертны и взаимодействуют с небольшим количеством веществ. Они не растворимы ни в каких растворителях. Однако растворением можно считать взаимодействие с водой с разрушением связей и образованием гидроксида металла и углеводорода.
О последней реакции и многих других интересных химических превращениях с участием карбидов мы поговорим в следующем разделе.
Химические свойства
Почти все карбиды взаимодействуют с водой. Какие-то — легко и без нагревания (например, карбид кальция), а какие-то (например, карбид кремния) — при нагревании водяного пара до 1800 градусов. Реакционная способность при этом зависит от характера связи в соединении, о котором мы поговорим позже. В реакции с водой образуются разные углеводороды. Происходит это потому, что водород, содержащийся в воде, соединяется с углеродом, находящимся в карбиде. Понять, какой углеводород получится (а может получиться как предельное, так и непредельное соединение), можно, исходя из валентности содержащегося в исходном веществе углерода. Например, если у нас есть карбид кальция, формула которого CaC2, мы видим, что он содержит ион C22-. Значит, к нему можно присоединить два иона водорода с зарядом +. Таким образом, получаем соединение C2H2 — ацетилен. Таким же образом из такого соединения, как карбид алюминия, формула которого Al4C3, получаем CH4. Почему не C3H12, спросите вы? Ведь ион имеет заряд 12-. Дело в том, что максимальное количество атомов водорода определяется формулой 2n+2, где n — количество атомов углерода. Значит, может существовать только соединение с формулой C3H8 (пропан), а тот ион с зарядом 12- распадается на три иона с зарядом 4-, которые и дают при соединении с протонами молекулы метана.
Интересными представляются реакции окисления карбидов. Они могут происходить как при воздействии сильных смесей окислителей, так и при обыкновенном горении в атмосфере кислорода. Если с кислородом всё понятно: получаются два окисда, то с другими окислителями интереснее. Всё зависит от природы металла, входящего в состав карбида, а также от природы окислителя. Например, карбид кремния, формула которого SiC, при взаимодействии со смесью азотной и плавиковой кислот образует гексафторкремниевую кислоту с выделением углекислого газа. А при проведении той же реакции, но с одной только азотной кислотой, получаем оксид кремния и углекислый газ. К окислителям также можно отнести галогены и халькогены. С ними взаимодействует любой карбид, формула реакции зависит только от его строения.
Карбиды металлов, формулы которых мы рассмотрели — далеко не единственные представители этого класса соединений. Сейчас мы подробнее рассмотрим каждое промышленно важное соединение этого класса и затем поговорим об их применении в нашей жизни.
Область применения
Карбид кальция (Calcium carbide) используется для получения цианамида кальция (методом реакции с азотом), из которого синтезируют цианистые соединения и удобрения, производства карбидно-карбамидных регуляторов роста растений и карбидного порошкового реагента.
Без этого вещества не обходится и проведение автогенных работ и освещения, изготовление ацетиленовой сажи и других материалов: синтетического каучука, алконитрила, стирола, винилхлорида, уксусной кислоты, хлорпроизводных ацетилена, искусственных смол, этилена, ацетона и др. Также оно применяется в процессе газосварки, производстве карбидных ламп.
Из специальной фракции calcium carbide (прошедшей переработку с применением отходов и некондиционного сырья) путем реакции с водой получают газ ацетилен и побочный продукт – гашеную известь. Эта процедура сопровождается выделением значительного количества тепла. Объем получаемого газа зависит от чистоты карбида кальция (чем чище материал, тем больше выйдет ацетилена) и варьируется в пределах 235-285 л от 1 кг карбида.
Теоретически для разложения 1 кг calcium carbide требуется 0,56 л воды, но на практике используют от 5 до 26 л жидкости, чтобы лучше охладить ацетилен и обеспечить безопасность процесса. Быстрота разложения будет зависеть от грануляции и чистоты исходного материала, а также от температуры и чистоты воды (чем чище и меньше размер, больше температура, тем выше скорость реакции).
Какие бывают карбиды?
Оказывается, карбид, формула которого, скажем, CaC2, существенно отличается по строению от SiC. И отличие это прежде всего в характере связи между атомами. В первом случае мы имеем дело с солеобразным карбидом. Назван этот класс соединений так потому, что ведёт себя фактически как соль, то есть способен диссоциировать на ионы. Такая ионная связь очень слабая, что и позволяет легко проводить реакцию гидролиза и многие другие превращения, включающие взаимодействия между ионами.
Другим, наверное, более промышленно важным видом карбидов являются ковалентные карбиды: такие как, например, SiC или WC. Они отличаются высокой плотностью и прочностью. А также тугоплавки и инертны к разбавленным химическим веществам.
Существуют также металлоподобные карбиды. Их скорее можно рассматривать как сплавы металлов с углеродом. Среди таких можно выделить, например, цементит (карбид железа, формула которого бывает разной, но в среднем она примерно такая: Fe3C) или чугун. Они имеют химическую активность, промежуточную по своей степени между ионными и ковалентными карбидами.
Каждый из этих подвидов обсуждаемого нами класса химических соединений имеет своё практическое применение. О том, как и где применяется каждый из них, мы поговорим в следующем разделе.
Методы получения карбидов
Карбиды могут быть получены взаимодействием углерода и его соединений с металлами или их соединениями. Известны следующие способы получения карбидов:
1) получение карбидов в литом виде;
2) науглероживание порошков металлов (или окислов) твердым углеродом;
3) науглероживание порошков металлов (или окислов) газами, содержащими углерод (часто в присутствии твердого углерода);
4) осаждение из газовой фазы (метод наращивания);
5) химическое выделение карбидной фазы или углеродистых ферросплавов или расплавов (метод растворения);
6) электролиз расплавов соответствующих солей.
Промышленное применение имеют первые три способа.
Получение литых карбидов основано на сплавлении металлов с углеродом и возможно только в электрической или высокочастотной печи, так как температуры образования и плавления карбидов тугоплавких металлов лежат в пределах 2500—4000° С. Это вызывает определенные технические трудности, поэтому способ получения литых карбидов имеет ограниченное применение.
Получение карбидов науглероживанием порошков металлов или окислов металлов твердым углеродом имеет наибольшее распространение и используется для промышленного приготовления карбидов вольфрама, титана, молибдена, тантала, ванадия и других карбидов, применяемых в производстве твердых сплавов.
В качестве исходного сырья при этом способе используют порошки чистых металлов или их окислов. Углерод вводят в смесь в виде тонкого порошка сахарного угля или сажи. Смесь металла (или окисла) с углеродом тщательно перемешивают в шаровых мельницах всухую или мокрым способом. При смешивании металла с твердым углеродом дают от 5 до 10% избытка углерода (по сравнению с теоретическим содержанием его), так как в металлических порошках имеется остаточный кислород, а также для компенсации частичного выгорания углерода в печи.
При использовании смесей окислов металла с углеродом учитывают науглероживающее действие образующейся окиси углерода и применяемого защитного газа. Обычно для реакции достаточно 80—90%-ного количества углерода, которое соответствует уравнению
Науглероживание (карбидизацию) проводят в одну или несколько стадий в электрических или реже в газовых печах. Кроме муфельных печей непрерывного действия, применяют угольные трубчатые печи сопротивления, методические печи с молибденовыми нагревателями и вертикальные трехфазные криптоловые печи, а также высокочастотные печи периодического действия с графитовыми тиглями.
В качестве защитного газа используют водород, окись углерода, метан и смеси этих газов. При получении карбидов волфрама и молибдена в качестве защитного газа можно использовать генераторный газ или диссоциированный аммиак.
Реакция науглероживания при образовании монокарбидов протекает по следующим уравнениям:
Температура реакции науглероживания металлов с твердым углеродом в зависимости от вида карбидов лежит в пределах 1200—2200° С. В табл. 10 приведены температуры реакций получения наиболее важных карбидов из металлов или окислов при науглероживании твердым углеродом в присутствии углеводорода.
Карбиды молибдена, вольфрама и тантала лучше всего получать науглероживанием металлических порошков сажистым углеродом при температуре 1200—1600°С.
Вольфрам образует два стойких при комнатной температуре карбида: W2C и WC. При науглероживании в твердом состоянии образуется преимущественно монокарбид вольфрама WC, при науглероживании в расплаве образуется W2C. Металлокерамические твердые сплавы содержат исключительно монокарбид вольфрама.
Карбид титана готовят из смеси возможно более чистой двуокиси титана с газовой сажей при температуре 1700—2100° С.
Получение карбидов науглероживанием металловили окислов углеродсодержащими газами. Выше было показано, что при карбидизации в твердом состоянии науглероживание частично происходит и через газовую фазу. В связи с этим возможно получение карбидов науглероживанием исключительно через газовую фазу. Для этого обычно используют металл и углеводород, в результате реакции получают карбид металла и водород. Газовая карбидизация металлов происходит при более высокой температуре.
Науглероживание окислов углеродсодержащими газами проводится редко.
Практическое применение карбидов
Как мы уже обсудили, ковалентные карбиды имеют самый большой диапазон практических применений. Это и абразивные и режущие материалы, и композиционные материалы, используемые в разных областях (например, в качестве одного из материалов, входящих в состав бронежилета), и автодетали, и электронные приборы, и нагревательные элементы, и ядерная энергетика. И это далеко не полный список применений этих сверхтвёрдых карбидов.
Самое узкое применение имеют солеобразующие карбиды. Их реакцию с водой используют как лабораторный способ получения углеводородов. То, как это происходит, мы уже разобрали выше.
Наравне с ковалентными, металлоподобные карбиды имеют широчайшее применение в промышленности. Как мы уже говорили, таким металлоподобным видом обсуждаемых нами соединений являются стали, чугуны и прочие соединения металлов с вкраплениями углерода. Как правило, металл, находящийся в таких веществах, относится к классу d-металлов. Именно поэтому он склонен образовывать не ковалентные связи, а как бы внедряться в структуру металла.
На наш взгляд, практических применений у вышеперечисленных соединений более чем достаточно. Теперь взглянем на процесс их получения.
Применение карбида кальция в вагранках
Карбид кальция широко применяется в чугунолитейном производстве как за рубежом, так и в наших литейных цехах.
Существуют два метода применения карбида кальция: продувка жидкого чугуна порошком CaC2 в струе инертного газа (например, азота) с целью обессеривания чугуна и улучшения его свойств, и ввод карбида кальция непосредственно в вагранку вместе с шихтой. Последний метод, ставящий своей целью повысить температуру металла, снизить расход кокса, увеличить производительность вагранки, рассматривается как один из способов интенсификации ваграночного процесса.
Карбид кальция дается в завалку вместе с коксом рабочей топливной колоши. Оптимальный расход карбида кальция составляет 2 % от металлозавалки. Присадка менее 0,75 % CaC2 практически не дает ощутимых результатов. Добавка более 2 % карбида кальция становится экономически нецелесообразной из-за высокой стоимости CaC2.
Карбид кальция в шихте является как бы дополнительным топливом. Благодаря высокой температуре плавления литейного карбида кальция (1650-1700 °С) последний проходит через шахту вагранки до плавильной зоны, где размягчается и плавится. Вблизи фурм, в области высокого содержания кислорода, жидкий карбид кальция интенсивно сгорает, причем 1 кг карбида кальция выделяет 23 106 Дж теплоты. Над фурмами образуется узкая зона высоких температур, порядка 1800 °С, в результате чего перегрев чугуна возрастает.
Присадка 2 % СаС2 увеличивает температуру металла на 40°-70 °С. Отмечается также снижение содержания серы, что объясняется уменьшением расхода кокса и более благоприятными условиями для обессеривания чугуна в связи с повышением температуры плавки.
Термическое действие карбида кальция в узкой по высоте зоне подтверждается характером разгара футеровки. Область максимального оплавления футеровки располагается над фурмами, причем она занимает меньшую площадь, но значительно глубже, чем при работе без CaC2.
Положительные результаты получены только при работе на эвтектическом (литейном) карбиде кальция, содержащем 72 % CaC2 и имеющем температуру плавления 1630-1650 °С. Обычный сварочный карбид содержит 80% CaC2, и температура плавления его равна 1850-1950 °С. При температурах ваграночного процесса сварочный карбид не горит, а следовательно, желаемого результата не достигается.
Добавка литейного карбида кальция сказывается на температуре металла уже первой колоши. Рекомендуется следующий порядок присадки CaC2: в первую и вторую колошу – 4 % литейного карбида, затем 1-3 % CaC2 к металлозавалке. В некоторых зарубежных литейных цехах карбид кальция вводится в течение первого часа работы вагранок с подогревом дутья, компенсируя инерционность устройств для нагрева воздуха.
Карбид кальция вводится кусками размером 15-50 мм (большие значения для крупных вагранок). При этом количество известняка в металлозавалке может быть уменьшено вдвое. Использование карбида кальция для интенсификации ваграночного процесса, снижение содержания серы и повышение температуры металла является перспективным благодаря отсутствию капитальных затрат и значительной эффективности его применения.
Получение карбидов
Первые два вида карбидов, которые мы рассмотрели, а именно ковалентные и солеобразные, получают чаще всего одним простым способом: реакцией оксида элемента и кокса при высокой температуре. При этом часть кокса, состоящего из углерода, соединяется с атомом элемента в составе оксида, и образует карбид. Другая часть «забирает» кислород и образует угарный газ. Такой способ очень энергозатратен, так как требует поддержания высокой температуры (порядка 1600-2500 градусов) в зоне реакции.
Для получения некоторых видов соединений используют альтернативные реакции. Например, разложение соединения, которое в конечном итоге даёт карбид. Формула реакции зависит от конкретного соединения, поэтому обсуждать её мы не будем.
Прежде чем завершить нашу статью, обсудим несколько интересных карбидов и поговорим о них подробнее.
КАРБИДЫ
КАРБИДЫ (от лат. carbo — уголь), соед. углерода с металлами, а также с бором и кремнием. По типу хим. связи карбиды делят на ионные (солеобразные), ковалентные и металлоподобные (ионно-ковалентно-металлические). Ионные карбиды (см. табл. 1) образуют металлы I и II гр. (соотв. М2С2 и МС2), РЗЭ и актиноиды (МС, М2С3, МС2), а также Аl. В этих соед. атом С в зависимости от типа гибридизации (sp3, sp2 или sp) образует ионы С4-, (C=C4-, (С=С=С)4-, (C=C)2-. Ковалентные карбиды (см. табл. 2) образуют В и Si; атом С в этих соед. находится в состоянии sp-, sp2- и sp3-гибридизации. Металлoподобные карбиды образуют переходные металлы IV-VII гр., Со, Ni и Fe. В этих карбидах связь металл-углерод ионно-ковалентная, причем атом С отрицательно заряжен, связь металл — металл чисто металлическая, атомы С между собой не связаны. Карбиды щелочных металлов кристаллизуются в решетках типа графита, атомы металлов размещаются между углеродными слоями, построенными из гексагoн. сеток. Карбиды щел.-зем. металлов кристаллизуются в гранецентрир. тетрагон. решетке типа СаС2, карбиды РЗЭ, монокарбиды актиноидов и переходных металлов в гранецентрир. кубической типа NaCl, сесквикарбиды актиноидов М2С3 в объемноцентрир. кубич. решетке типа Рu2С3. Ионные карбиды щелочных металлов разлагаются при т-ре ок. 800 °С, карбиды щел.-зем. металлов в интервале 1800-2300°С, ковалентные карбиды и металлоподобные разлагаются и плавятся при более высоких т-рах. В периодич. системе в пределах группы т-ры плавления карбидов возрастают с увеличением порядкового номера металла и обычно в 1,5-2 раза выше, чем т-ры плавления соответствующих металлов. Это обусловлено высокой прочностью связи М-С. Металлоподобные карбиды обладают металлич. проводимостью, для них характерен положит. температурный коэф. r. Для сесквикарбидов величина r (достигает 500 мкОм.см) примерно на порядок выше, чем для дикарбидов и монокарбидов (20-50 мкОм.см). Дикарбиды РЗЭ также обладают металлич. св-вами. Карбиды В и Si, а также Be, Mg и Аl — полупроводники. Мех. св-ва карбидов зависят от прочности хим. связи, степени ее ковалентности и межатомного расстояния. наиб. высокой твердостью обладают карбиды В, Si, Be, а также монокарбиды РЗЭ и переходных металлов; твердость последних уменьшается при переходе от карбидов подгруппы IVа к карбидам подгруппы VIa. Все карбиды при комнатной т-ре — хрупкие в-ва, их пластич. деформация возможна в условиях всестороннего сжатия при очень высоких напряжениях. Ионные карбиды разлагаются водой с образованием метана, ацетилена, метилацетилена или смеси углеводородов и гидроксида металла, напр.:Аl4С3 + 12Н2О : 4Аl(ОН)3 + 3СН4;
Na2C2 + 2Н2О : 2NaOH + С2Н2;
Mg2C3 + 4Н2О : 2Mg(OH)2 + С3Н4.
Ковалентные и металлоподобные карбиды не разлагаются водой и большинством минер. к-т и щелочей. Получают карбиды из элементов, восстановлением оксидов металлов, газофазным способом, металлотермически. Синтез из элементов осуществляют при высоких т-рах в вакууме или инертной атмосфере. В зависимости от технол. параметров процесса образуются порошки с размером частиц от 0,5 мкм до 2 мм. Синтез может осуществляться в режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла, либо в плазме при 5000-10000 К в дуговых, высокочастотных и сверхчастотных плазмотронах. В результате быстрого охлаждения из парогазовой смеси элементов в плазмообразующем газе (Аr или Не) образуются ультрадисперсные порошки с размерами частиц 10-100 нм. Восстановлением оксидов металлов производят наиб. важные соед. — бора карбиды, кремния карбиды, а также вольфрама карбиды, титана карбид и др. Карбиды переходных металлов. Газофазным способом получают карбиды из хим. соед., к-рые испаряются, разлагаются, а затем восстанавливаются и взаимод. друг с другом, напр.:
2МСl + 2ССl4 + 5Н2 : 2МС + 10НСl.
Чаще всего этот синтез осуществляют в плазме, получая дисперсные порошки. По металлотермич. способу оксиды металлов восстанавливают металлами (Mg, Al или Са) в присут. углерода, напр.:
МО + С + Мg : МС + МgО.
Особо чистые карбиды, не содержащие кислорода и азота, синтезируют взаимод. С и металла в расплаве др. металла или сплава, напр. TiC получают в сплаве Fe Ni. Из ионных карбидов наиб. важен кальция карбид СаС2, из ковалентных В4С и SiC. Металлоподобные карбиды упрочняют чугун и сталь [Fe3C, (Fe,Cr)3C, Fe2W2C, (Fe,Cr,Mo)23C6], они являются основой твердых вольфрама сплавов (WC, TiC, WC, TiC, TaC, WC) и др. твердых сплавов (TiC, VC, Сr3С2, ТаС), используемых для обработки металлов резанием. Карбиды применяют также как восстановители, раскислители и катализаторы, они входят в состав жаропрочных и жаростойких композиционных материалов, в т. ч. керметов. === Исп. литература для статьи «КАРБИДЫ»: Стормс Э., Тугоплавкие карбиды, пер. с англ., М., 1970; Гольдшмидт X., Сплавы внедрения, пер. с англ., в. 1-2, М, 1971, Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М, 1974. Самсонов Г. В., Упадхая Г. Ш., Нешпор В. С., Физическое материаловедение карбидов, К., 1974, Высокотемпературные карбиды, под ред. Г. В. Самсонова, К, 1975, Карбиды и сплавы на их основе, под ред. Г. В. Самсонова, К, 1976, Свойства, получение и применение тугоплавких соединений, Справочник, под ред. Т. Я. Косолаповой. М, 1986, П. С. Кислый.
Страница «КАРБИДЫ» подготовлена по материалам химической энциклопедии.
Интересные соединения
Карбид натрия. Формула этого соединения C2Na2. Это можно представить скорее как ацетиленид (то есть продукт замещения атомов водорода в ацетилене на атомы натрия), а не карбид. Химическая формула полностью не отражает этих тонкостей, поэтому их надо искать в строении. Это очень активное вещество и при любом контакте с водой очень активно взаимодействует с ней с образованием ацетилена и щёлочи.
Карбид магния. Формула: MgC2. Интересны способы получения этого достаточно активного соединения. Один из них предполагает спекание фторида магния с карбидом кальция при высокой температуре. В результате этого получаются два продукта: фторид кальция и нужный нам карбид. Формула этой реакции достаточно проста, и вы можете при желании ознакомиться с ней в специализированной литературе.
Если вы не уверены в полезности изложенного в статье материала, тогда следующий раздел для вас.
Как это может быть полезно в жизни?
Ну, во-первых, знание химических соединений никогда не может быть лишним. Всегда лучше быть вооружённым знанием, чем остаться без него. Во-вторых, чем больше вы знаете о существовании определённых соединений, тем лучше понимаете механизм их образования и законы, которые позволяют им существовать.
Перед тем как перейти к окончанию, хотелось бы дать несколько рекомендаций по изучению этого материала.