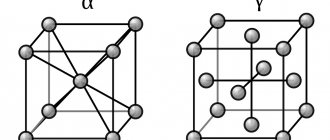
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
Источник
Кристаллическое строение металлов
Установки для автоматической сварки продольных швов обечаек — в наличии на складе!
Высокая производительность, удобство, простота в управлении и надежность в эксплуатации.
Сварочные экраны и защитные шторки — в наличии на складе!
Защита от излучения при сварке и резке. Большой выбор. Доставка по всей России!
У металлов электроны на внешних оболочках имеют слабую связь с ядром, легко отрываются и могут свободно перемещаться между положительно заряженными ядрами. Следовательно, в металле положительно заряженные ионы окружены коллективизированными электронами. Так как эти электроны подвижны аналогично частицам газа, то используется термин «электронный газ».
Металлургический тип связи характерен тем, что нет непосредственного соединения атомов друг с другом, нет между ними прямой связи. Атомы в металлах размещаются закономерно, образуя кристаллическую решетку.
— это мысленно проведенные в пространстве прямые линии, соединяющие ближайшие атомы и проходящие через их центры, относительно которых они совершают колебательные движения. В итоге образуются фигуры правильной геометрической формы — кристаллическая решетка (рис. 1.1).
Рис. 1.1. Схема кристаллической решетки
Расстояния (а,b,с) между атомами , т.е. параметры кристаллической решетки, находятся в пределах 2… 6 Ao (1 Ao=10-8 см). Каждый атом принадлежит 8 кристаллическим решеткам. В аморфных телах с хаотическим расположением атомов в пространстве, свойства в различных направлениях одинаковы, а в кристаллических телах расстояния между атомами в различных направлениях неодинаковы, поэтому различны и свойства. Тип кристаллической решетки (рис. 1.2) зависит от металла, температуры и давления. Это используется при термообработке металлов для упрочнения их.
состоят из большого количества кристаллов, различно ориентированных в пространстве относительно друг друга. На границах зерен атомы кристаллов не имеют правильного расположения, здесь скапливаются примеси, дефекты и включения. Экспериментально установлено , что внутреннее кристаллическое строение зерен не является правильным. В решетках имеются различные дефекты (несовершенства), которые нарушают связь между атомами и оказывают влияние на свойства металлов.
Имеются следующие несовершенства в кристаллических решетках:
- Точечные (рис. 1.3): а) Наличие вакансий, т. е. мест в решетке, не занятых атомами. Это происходит из-за смещения атомов от равновесного состояния. Число вакансий увеличивается с ростом температуры. б) Дислоцированные атомы, т. е. атомы вышедшие из узла решетки и занявшие место в междоузлии. в) Примесные атомы, т.е. в основном металле имеются чужеродные примеси. Например, в чугуне основными атомами являются атомы железа, а примесными- атомы углерода, которые или занимают место основного атома, или внедряются внутрь ячейки.
- Поверхностные несовершенства, имеющие небольшую толщину при значительных размерах в двух других направлениях.
- Линейные несовершенства (цепочки вакансий, дислокаций и т. д.). Линейные дефекты малы в двух направлениях и значительно большего размера в третьем.
Рис. 1.2. Виды кристаллических решеток Рис. 1.3. Дефекты кристаллической решетки.
Количество дефектов в металле оказывает существенное влияние на его прочность.
Повышение прочности с увеличением плотности дислокаций выше их критического значения объясняется тем, что имеются не только параллельные, но и взаимопересекающиеся (объемные) дислокации. Они препятствуют взаимному перемещению металла и, как результат, приводят к увеличению прочности металла.
Все современные способы упрочнения металлов (легирование, закалка, прокатка, ковка, штамповка, волочение и т.д.) – это увеличение количества дефектов в металле. Наивысшая прочность, которую можно получить путем увеличения количества дефектов в металле , составляет около 1/3 от теоретически возможной (идеальной) прочности.
Российские ученые и практики сделали много открытий в металловедении и технологии обработки металлов. Так, основы научной металлургии и геологии заложил еще Михаил Васильевич Ломоносов, об этом свидетельствует написанный им в 1763 году труд «Первые основания металлургии или рудных дел».
Дмитрий Иванович Менделеев
систематизировал в периодической таблице химические элементы, что способствовало развитию многих вопросов металловедения (из известных в то время 63 химических элемента 50 были металлами). Родоначальником металлургии является и русский горный инженер Павел Петрович Аносов
(1797…1851 г.), работающий в городе Златоусте на Урале. Он впервые применил световой микроскоп для изучения микроструктур металлов и нашел секрет булатной стали, заложил основы легирования стали (исследовал добавки золота, платины, хрома, марганца и других элементов к стали).
Дмитрий Константинович Чернов
(1839…1921 г.) — основоположник теории и строения стального слитка. Работал на Обуховском заводе г. Санкт-Петербурга.
Источник: Н.В. Храмцов. Металлы и сварка (лекционный курс)
Физические свойства меди:
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 132 пм |
| 207 | Радиус иона (кристаллический) | Cu + (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 140 пм |
| 209 | Электроны, Протоны, Нейтроны | 29 электронов, 29 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 306 | Энергия сродства атома к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,96 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
8,02 г/см 3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость),
7,962 г/см 3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость), 7,881 г/см 3 (при 1227 °C и иных стандартных условиях, состояние вещества – жидкость), 7,799 г/см 3 (при 1327 °C и иных стандартных условиях, состояние вещества – жидкость), 7,471 г/см 3 (при 1727 °C и иных стандартных условиях, состояние вещества – жидкость), 7,307 г/см 3 (при 1927 °C и иных стандартных условиях, состояние вещества – жидкость),
7,225 г/см 3 (при 2027 °C и иных стандартных условиях, состояние вещества – жидкость), 7,102 г/см 3 (при 2177 °C и иных стандартных условиях, состояние вещества – жидкость)
Химическая связь и типы кристаллов
ЛЕКЦИЯ 2.
2.1. Химическая связь и типы кристаллов.
Все многообразие кристаллических веществ можно свести к нескольким типам, если рассматривать (учитывать) вид частиц, из которых построена кристаллическая решетка, и природу сил взаимодействия между ними (табл. 2.1 −2.2). При таком подходе важной характеристикой кристалла становится энергия кристаллической решетки (табл. 2.3), которую определяют как энергию, затрачиваемую на разрушение данного монокристалла и удаление образующих его частиц за пределы их взаимодействия. Она определяет механические свойства тела, а также температуру и теплоту плавления вещества.
Таблица 2.1. Сравнение характера химической связи.
| Сравнение | Связи | |||
| Атом-ковалентная | Ионная | Металлическая | Межмолекулярная | |
| По способу образования связи | За счет обобщенной пары электронов | За счет взаимного притяжения разноименно заряженных ионов | За счет притяжения ионов металлов и свободных электронов | Взаимодействие молекул за счет Ван-дер-ваальсовых сил |
| По характеру принимающих в образовании связи атомов или ионов | Преимущественно неметаллы | Преимуществен-но ионы металла и неметалла | Ионы металла и свободные электроны | Полярные и неполярные молекулы |
Таблица 2.1. Типы кристаллов и свойства веществ.
| Свойства веществ | Тип кристаллов | |||
| Молекулярные | Ионные | атомно-ковалентные | металлические | |
| Частицы | Молекулы | Ионы | Атомы | Атом-ионы |
| Тип связей между частицами | Вандерваальсовы взаимодействия | Ионные | Ковалентные | Металлические |
| Энергия связей | Невысокая | Высокая | Высокая | От средней до высокой |
| Температура плавления | Низкая | Высокая | Высокая | От низкой до высокой |
| Механические свойства | Мягкие | Твердые и хрупкие | Очень твердые | От мягких до очень твердых |
| Электрическая проводимость | Типичные диэлектрики | Диэлектрики (в твердом состоянии) | От диэлетриков до полупроводников | Электронная |
| Примеры веществ | C6H6, О2 , N 2, I2, S, CO2, H2O | KCI, CaF2, Na2CO3 | С, Ge, Si, SiO2, SiC | Li, Ca, Zn, Ni |
Молекулярные кристаллы.
К этой группе относятся кристаллы газов, некоторых оксидов и галогенидов (табл. 2.2). В узлах решеток находятся молекулы, между которыми действуют сравнительно слабые силы Ван−дер−Ваальса. Это и определяет низкие температуры плавления или сублимации, мягкость или хрупкость, а также необычайно высокое давление паров над их поверхностью. Наличие запаха у таких твердых веществ, как бензол, нафталин или йод, свидетельствуют о том, что их молекулы легко испаряются с поверхности твердого вещества. Кристаллы с полярными молекулами в узлах (например, Н2O) имеют более высокую прочность и температуру плавления, чем кристаллы с неполярными молекулами в узлах (например, СН4). Электропроводность молекулярных кристаллов ничтожно мала, потому что в их молекулах существует прочная ковалентная связь, и способность электронов перемещаться между молекулами оказывается чрезвычайно низкой.
Таблица 2.3. Характеристики некоторых веществ
| Вещество | Вид кристалла | Энергия решетки, кДж/Моль | Температура плавления, °С | Электрическая проводимость при 298 К, (Ом*м)−1 |
| СН4 | Молекулярный | 10,0 | -182 | — |
| НСl | Молекулярный | 21,3 | -112 | — |
| H20 | Молекулярный | 50,2 | 0 | — |
| С (алмаз) | Атомно-ковалентный | 715 | 3500 | 1-10-13 |
| Ge | Атомно-ковалентный | 369 | 938 | 1-2 |
| NaCI | Ионный | 775 | 801 | 1*10-15 |
| Na | Металлический | 108,3 | 98 | 2,4 • 107 |
| А] | Металлический | 310 | 660 | 3 |
| Zn | Металлический | 131 | 420 | 1,7- 107 |
| Мо | Металлический | 651 | 2620 | 1,3 • 107 |
Рис. 2.1. Кристаллическая структура хлорида натрия.
Светлые шары — Na+, темные шары — Сl-. Слева − элементарная ячейка NaCl.
Ионные кристаллы.
Структурными единицами кристаллов этого типа являются положительно и отрицательно заряженные ионы, силы электростатического взаимодействия между которыми достаточно велики. Поэтому, как правило, вещества ионного типа имеют высокие температуры плавления и кипения, характеризуются чрезвычайно низким давлением паров и растворяются только в наиболее полярных растворителях. Сухие ионные кристаллы относятся к диэлектрикам, поскольку образующие их ионы не могут свободно мигрировать в сторону от своих равновесных положений в узлах кристаллической решетки, а электроны локализованы. Наличие электропроводности характерно только для расплавов или растворов ионных веществ (ионная проводимость). Из-за ненаправленности и ненасыщенности связей и сферической формы частиц каждый ион окружается наибольшим возможным числом противоположно заряженных ионов. Координационные числа (КЧ) зависят от соотношения радиусов катиона и аниона и обычно составляют 4 ÷ 8 единиц. Например, в решетках NaCI (рис.2.1) и KCl КЧ равно 6 ( = 0,73 ÷ 0,41).
Рис. 2.2. Структура алмаза:
а − гибридизация орбиталей атома углерода; б — схема направлений химических связей,
в —
решетка.
Атомно-ковалентные кристаллы.
Одним из наиболее известных представителей ковалентных кристаллов является алмаз. В кристаллической структуре алмаза каждый атом углерода ковалентно связан с четырьмя соседними атомами углерода, располагающимися вокруг него в тетраэдрической конфигурации (рис. 2.2,б−в). Ориентация четырех возникающих в этом случае связей ничем не отличается от существующей в молекулах с простыми углерод-углеродными связями, поэтому весь кристалл алмаза можно рассматривать как одну молекулу.
Так как в узлах кристаллов располагаются атомы, образующие друг с другом прочные ковалентные связи, это обусловливает высокую энергию решетки и соответственно физические свойства веществ: они тверды, тугоплавки, малолетучи (табл. 2.2). Из-за направленности ковалентных связей координационные числа и плотность упаковки в атомно-ковалентных кристаллах обычно невелики. Так, в кристалле алмаза углерод имеет sp3-гибридизацию (рис. 2.2, а) и координационное число 4. Ковалентные кристаллы, как правило, плохие проводники электричества. Однако при повышении температуры или наличии незначительных примесей (1:107) электрическая проводимость может сильно возрасти.
Металлические кристаллы и связь.
75 элементов в периодической системе образуют металлические решетки, в которых каждый атом элемента окружен определенным числом аналогичных атомов, регулярным образом расположенных в пространстве. У типичных металлов на внешней электронной оболочке имеется значительное число вакантных орбиталей и малое число электронов, которые сравнительно слабо удерживаются своими атомами, что следует из низких значений энергий ионизации (ЭИ) и сродства к электрону (ЭСЭ) по сравнению с атомами неметаллов. Например, у элементов III периода натрия ЭИ = 5,14 эВ, ЭСЭ -= 0,548, у кремния ЭИ = 8,15 эВ, ЭСЭ = 1,385 эВ, в то время как у хлора ЭИ = 12,97 эВ, ЭСЭ = 3,67 эВ. Поэтому внешние электроны в кристаллической решетке металла легко покидают свои атомы, превращая их тем самым в положительно заряженные ионы (рис. 2.3.). Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость решетки. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с чисто металлической связью (s — и p-металлы) характеризуются относительно невысокими температурами плавления и твердостью. Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокие электрическую проводимость и теплопроводность, а также ковкость и пластичность металлов. Металлический блеск обусловлен отражением световых лучей от «электронного газа», который несколько выходит за границу положительно заряженных ионов.
Рис. 2.3. Кристаллическая решетка металла.
Катионы металлов, как и атомы, обладают сферической симметрией. Поэтому кристаллическую структуру металлов можно рассматривать как пространственную плотнейшую упаковку твердых шаров одинакового радиуса, возможные варианты укладки которых показаны на рис. 2.4. На первый слой шаров в образованные тремя шарами первого слоя лунки накладывается второй слой шаров. Для третьего слоя шаров возможны два варианта: а) если шары третьего слоя укладываются точно над шарами первого слоя, то решетка получается гексагональная и называется гексагональной
плотной укладкой (ГПУ); б) если третий слой шаров укладывается на второй слой над лунками второго (т. е. шары третьего слоя оказываются смещенными по сравнению с шарами как второго, так и первого слоя) и только четвертый слой шаров повторяет первый слой шаров
,
то получается гранецентрированная кубическая решетка (ГЦК). В описанных плотноупакованных структурах геометрически максимально возможное число соседей для каждого атома равно 12 (т. е КЧ = 12), а объем незанятого пространства составляет 26 %.
Рис. 2.4. Элементарные ячейки кристаллических решеток:
а — ГПУ; б — ГЦК.
Таблица 2.4. Кристаллические структуры некоторых металлов в стандартных условиях.
| Кристаллическая структура | Элементы |
| ГПУ | Be, Cd, Co, Mg, Ti, Zn, Zr, Hf |
| ГЦК | Ag, Au, Al, Ca, Cu, Ni, Pb, Pd, Rh, Ir, Pt, |
| ОЦК | Щелочные металлы, Ba, Si, Ge, Fe, Mo, Mn, Nb, Ta, W |
| Р | Po |
Как правило, металлы кристаллизируются в плотноупакованных гексагональных (ГПУ) или кубических гранецентрированных (ГЦК) структурах (табл. 2.4). Но существуют и другие способы упаковки, среди которых достаточно распространена кубическая объемноцентрированная структура (ОЦК) (рис. 2.5). Частицы в такой структуре занимают вершины и центр куба, КЧ равно 8, а объем незаполненного пространства составляет 32 %. Необходимо отметить, что при нагревании, когда увеличивается амплитуда тепловых колебаний атомов, плотно упакованные металлические структуры могут претерпевать фазовые переходы к менее плотно упакованным структурам
Рис.2.5. Кубическая объемноцентрированная ячейка (а) и ее решетка (б).
Пустое пространство образуют тетраэдрические и октаэдрические поры (рис. 2.6). Тетраэдрические пустоты образованы плоским треугольником из соприкасающихся сфер и сферой, лежащей в углублении (рис. 2.7, а). Октаэдрические пустоты находятся между двумя повернутыми относительно друг друга треугольниками из шаров соседних слоев и образованы шестью близлежащими сферами, центры которых расположены в вершинах октаэдра (рис. 2.7, б). Структуры многих твердых веществ, включая сплавы, могут быть приблизительно описаны как плотнейшие упаковки атомов одного сорта, в которых пустоты заняты другими атомами. Как показали расчеты, октаэдрическая пустота может вместить сферу радиуса 0,414R, а тетраэдрическая − сферу радиуса 0,255R, где. R − радиус сферы
Рис. 2.6. Пустоты в плотной упаковке шаров:
О- тетраэдрическая; ● — октаэдрическая
Рис. 2.7. Образование тетраэдрической (а) и октаэдрической (б) пустот в плотнейшей упаковке шаров.
Описанные структуры позволяют объяснить многие свойства металлов. Например, хорошая ковкость таких металлов, как серебро или медь, обусловлена тем, что в их кристаллах слои атомов способны скользить вдоль так называемых плоскостей скольжения
. Наличие в металле небольшого количества примесей, как, например, в сплавах, означает появление в их кристаллической решетке атомов другого размера. Такие неоднородности могут очень сильно искажать плоскости скольжения и препятствовать скольжению одних атомных плоскостей вдоль других. Ярким примером такого влияния служит сплав меди с небольшим количеством (< 1 %) количеством бериллия. Этот сплав обладает такой твердостью и упругостью, что из него получаются прекрасные пружины, хотя медь — довольно мягкий и податливый металл.
Кристаллы со смешанными связями.
Тот или иной вид химической связи или взаимодействия в чистом виде в кристаллах встречается редко. Обычно между частицами существуют сложные взаимодействия, которые можно описать наложением двух или более видов связей друг на друга.
Так, например, в атомных кристаллах наряду с ковалентной связью могут существовать вандерваальсовы силы, как у одной из аллотропных модификаций углерода — графита. При образовании кристаллов графита у углерода происходит sp2-
гибридизация с образованием двумерных (плоских) структур, у которых валентные углы связей равны 120° (рис. 2.8). Длина связи С-С в плоскости равна 0,142 нм. Четвертый валентный электрон (p-электрон) каждого атома вступает в p-связь между соседними атомами. Эти p-электроны очень подвижны и обеспечивают электронную проводимость. Между плоскими слоями графита возникает слабое вандерваальсово взаимодействие, длина связи составляет 0,35 нм.
Прочные ковалентные связи (716 кДж/моль) беспечивают графиту высокую температуру плавления и химическую стойкость, наличие подвижных электронов p-связи — электрическую проводимость и теплопроводность. Так, электронная проводимость монокристалла в направлении, параллельном плоскости sp2-гибридизации составляет 2,6•106 (Ом•м)-1. Из-за слабых вандерваальсовых сил (энергия связи 17 кДж/моль) между слоями графит очень мягок, легко расслаивается что позволяет использовать его как смазку и как наполнитель стержней карандашей.
Рис. 2.8. Структура графита.
Слева − гибридизация орбиталей атома углерода.
Вследствие большого расстояния между плоскостями и низкой энергии связи между плоскостями графита могут внедряться атомы других элементов, например фтор, щелочные металлы, ионы или молекулы, например LiC1, FeCl3. В результате получаются соединения графита, например C6Li, C8K. Такие соединения называются интеркалятами или слоистыми соединениями. Процесс вхождения молекул, ионов или атомов в решетку называется интеркалированием: C+xF = CFx. Интеркалирование характерно не только для графита, но и для многих других простых веществ и соединений, например TiS2, V2O5,
MnO2.
При включении атомов, ионов или молекул в графит изменяются межплоскостные расстояния кристалла графита и его свойства. Например, электрическая проводимость некоторых интеркалятов графита приближается к проводимости металлов, а иногда и ее превосходит. Интеркаляты уже находят применение для изготовления проводов, соединения графита с фтором и литием используются в качестве электродов новых энергоемких химических источников тока.
2.2. Дефекты в кристаллах.
Кристалл, состоящий из совершенно одинаковых элементарных ячеек, называется идеальным. Реальные твердые тела состоят из отдельных монокристаллов (кристаллитов), сросшихся друг с другом и имеющих межкристаллитную границу раздела. Отдельные кристаллиты в свою очередь имеют те или иные отклонения от регулярного расположения частиц, называемые дефектами структуры.
Дефекты условно подразделяют на динамические (временные) и статистические (постоянные). Динамические дефекты
возникают при механических, тепловых или электромагнитных воздействиях на кристалл и т. п. Наиболее распространенным видом динамических дефектов являются фононы — временные искажения регулярности решетки, вызванные тепловым движением атомов. Среди
статистических дефектов
различают протяженные (линейные и плоские) и атомные (точечные) несовершенства структуры.
Линейные дефекты
, или дислокации (слово «дислокация» в переводе на русский означает «смещение»), — это нарушения идеального расположения групп частиц, которые можно расположить вдоль воображаемой прямой или кривой, например винтовой, линии. Плоские дефекты — это смещение положения групп частиц, которые можно расположить на какой-либо плоскости.
Точечные дефекты
– это: а) отсутствие иона или атома в узлах решетки (так называемые вакансии, называемые дефектом Шоттки по имени описавшего этот тип дефекта немецкого физика, рис. 2.9а); б) смещение ионов или атомов из узла в междоузлие (дефект Френкеля, рис. 2.9б); в) внедрение в междоузлие (рис. 2.9в) или узел решетки чужеродного атома или иона (примесный дефект). Наибольшее влияние на химические и некоторые физические свойства (механическую прочность, электропроводность и пр.) оказывают именно точечные дефекты, к основным причинам возникновения которых относят тепловое движение частиц, наличие в кристаллах примесей и несоблюдение стехиометрии (количественных соотношений между веществами, претерпевающими химические превращения) в кристаллах.
Рис. 2.9. Точечные дефекты в кристаллической решетке.
а — вакансия; б — междоузельный атом; в — примесный атом внедрения
В кристаллической решетке частицы располагаются на расстояниях, при которых энергия кристаллической решетки минимальна. Частицы совершают колебательные движения около положения равновесия, энергия которых подчиняется распределению Максвелла – Больцмана. Частицы, обладающие максимальной энергией, могут покинуть узел и перейти в междоузлие на более высокий энергетический уровень. Таким образом, возникают тепловые дефекты, вероятность возникновения которых увеличивается в зависимости от температуры по экспотенциальному закону:
, ( )
где n – число вакансий в единице объема кристалла; Q – энергия образования пары вакансия – атом в междоузлии; R – газовая постоянная; T – температура в шкале Кельвина; a – постоянная величина для данного кристалла. Вакансии могут возникать в решетках любого типа, ослабляя связи между частицами в кристалле.
Перемещения междоузельных частиц или частиц из узла в соседнюю вакансию (дефект Френкеля) определяют диффузию в кристаллах и электропроводность кристаллов солей и оксидов (так называемых твердых электролитов). При этом возможно как перемещение ионов (ионная проводимость), так и перемещение вакансий, иначе называемых дырками (дырочная проводимость). В кристаллах ZrO2, содержащего небольшое количество (молярная доля 8-15 %) оксидов щелочно-земельных металлов, например СаО, или редкоземельных металлов, например Y2O3,
имеются ионные вакансии в связи с меньшим количеством кислорода на один атом у Y или Са в этих оксидах. Смешанные оксиды (ZrO2)0,9(Y2O3)0,1 служат электролитами в новых перспективных источниках энергии — топливных элементах. Приемлемая ионная проводимость у этих оксидов наступает при 0C. Однако в последние годы обнаружены некоторые твердые электролиты, ионная проводимость которых при комнатной температуре на 5-6 порядков выше ионной проводимости классических твердых электролитов и приближается к электрической проводимости растворов электролитов. Такие твердые вещества получили название суперионных проводников, или суперионников. Примерами могут служить Cu4RbCl3I2, Na2O*11Al2O3, AgI, LiI, Li3N Некоторые из них нашли применение в новых химических источниках тока.
Существование в кристаллах вакансий (дефект Шоттки) определяет возможность изменения состава кристалла и образование фаз переменного состава (т. е. с отклонением от закона постоянства состава). Так, например, в зависимости от способа получения оксид титана может стабильно существовать при изменении состава от TiO0,6 до TiO1,33, а сульфид железа – от Fe0,8S до FeS1,1. Тип кристаллической решетки при этом не изменяется, а свойства могут стать другими. BaO, NaCl, KCl – бесцветные кристаллы, а при некотором избытке металла становятся соответственно голубыми, желтыми, фиолетовыми. Для обеспечения тех или иных свойств некоторые кристаллы специально синтезируют с нарушением стехиометрии, например, для получения фоточувствительных мишеней в цветных телевизорах.
В настоящее время нестехиометрические соединения являются предметом многих исследований, в значительной мере обусловленных тем, что некоторые из них обладают высокотемпературной сверхпроводимостью. У сверхпроводников при температуре, близкой к абсолютному нулю, (Tк) электрическое сопротивление падает практически до нуля. Температура Тк традиционных сверхпроводников (например, Nb3Ge, Nb3AlGe) не превышала 23 К. В 1986 году Дж. Беднорц и К. Мюллер открыли, что у соединения La2-xBaxCuO4-d (где d — нестехиометричность соединения), температура Тк значительно выше (30-35 К). Соединения с относительно высокими значениями критических температур Тк стали называться высокотемпературными сверхпроводниками. Критическая температура некоторых из них не только приближается к температуре жидкого азота (77 K)[например, у La2LuBa3Cu6O14+d Тк = 50-65 K], но и превышает ее [например, у Yba2Cu3O7-d Тк = 90 K,
у (Tl1-xPb2O)m*Ba(Sr2)Ca1-nCunO2n +2-d Тк = 85-122 K].
Примесные дефекты
обусловлены частицами примесей, попадающими в тело при его кристаллизации. Наличие примесных дефектов неизбежно, поскольку абсолютно чистое вещество получить нельзя. Современные методы очистки позволяют получить материал очень высокой чистоты, содержащий не более 10-8 – 10-10 вес. % примесей от основного материала. Такие примеси могут вызвать полупроводниковые свойства у некоторых твердых тел с атомно-ковалентными кристаллами. В собственные полупроводники примеси вносят целенаправленно для того, чтобы изменить его полупроводниковые свойства. Примесные атомы размещаются в узлах основной кристаллической решетки или, если атомы примеси достаточно малы, в междоузлиях.
2.3. Жидкие кристаллы.
Жидкие кристаллы (ЖК) — это жидкости с упорядоченной молекулярной структурой, благодаря чему они занимают промежуточное положение между кристаллами и обычными жидкостями с беспорядочным расположением молекул. Жидкие кристаллы текучи, как обычные жидкости, но в то же время обладают анизотропией свойств, как кристаллы.
Молекулы жидких кристаллов представляют собой крупные органические молекулы с асимметричной формой основной цепи и полярной группой на конце, например, −CN, −NO2, −NH2. Например, при комнатной температуре свойства жидкого кристалла проявляет 4-пентил-4′-цианобифенил:
Его молекула на концах вытянутой в одном направлении группировки атомов имеет различные по характеру группы: полярную и неполярную. Также имеется длинная цепочка атомов с делокализованными π-электронами. Молекула обладает высокой поляризуемостью и активно взаимодействует посредством межмолекулярных сил с другими молекулами, ориентированными параллельно оси ее преимущественной ориентации п.
Поэтому в жидкости соблюдается дальний порядок расположения молекул в одной плоскости. В результате наблюдается анизотропия векторных свойств.
По структуре жидкие кристаллы разделяют на три класса: I, II, III (рис. 2.10).
Рис. 2.10. Типы структур жидких кристаллов.
а) нематические; б) смектические; в) холестерические.
В кристаллах первого класса (рис. 2.10, а) стержнеобразные молекулы выстроены в цепочки; направление преимущественной ориентации молекул является оптической осью жидкого кристалла. В кристаллах второго класса (рис. 2.10, б) дискообразные молекулы образуют параллельные слои, которые легко смещаются друг относительно друга. В кристаллах третьего класса (рис. 2.10, в) структура наиболее сложная: молекулы размещаются по пространственной спирали и содержат асимметрический атом углерода. Длинные молекулы образуют параллельные слои, в каждом слое имеется структура жидкого кристалла первого класса. Направление преимущественной ориентации плавно меняется при переходе от слоя к слою, образуя спираль с определенным шагом.
Ориентационный порядок в жидких кристаллах легко изменяется под действием давления, электрического и магнитного полей, нагрева. Это явление дает возможность управлять их векторными свойствами (электропроводностью, магнитной восприимчивостью, диэлектрической проницаемостью и др.) путем слабых воздействий и делает жидкие кристаллы незаменимыми материалами для изготовления особо чувствительных индикаторов. Далеко не полный перечень областей применения жидких кристаллов приводится в табл. 2.5.
В жидких кристаллах первого класса наблюдается электрооптический эффект динамического рассеяния света. Сущность эффекта заключается в нарушении исходной упорядоченности молекул под действием электрического поля достаточной напряженности, появлением турбулентного перемешивания молекул и увеличением прозрачности. Жидкие кристаллы используют в цветных индикаторах и других цветовых устройствах. Для цветных изображений применяют смеси жидких кристаллов с красителями, также имеющими продолговатые молекулы. При низкой напряженности поля молекулы жидкого кристалла размещаются перпендикулярно электродам ячейки и увлекают за собой молекулы красителя. В таком положении окраска не видна. При вращении молекул под влиянием поля более высокой напряженности молекулы красителя окрашивают изображение в определенный цвет.
Таблица 2.5. Применение жидких кристаллов.
| Внешнее воздействие | Область применения | Тип ЖК |
| температура | Индикаторы температуры | Холестерики |
| Оптические фильтры | Холестерики, нематики | |
| Визуализация излучения и голография | Холестерики, нематики | |
| Тепловая самофокусировка света | нематики | |
| Химические примеси | Анализ газовых смесей | холестерики |
| криминалистика | холестерики | |
| Электромагнитное поле | Электрооптические экраны | Холестерики, нематики, смектики |
| Модуляторы и управляемые оптические фильтры | Нематики | |
| Материалы для нелинейной оптики | смектики | |
| Неразрушающий контроль электрических цепей | нематики | |
| Фотохимическая запись изображения | холестерики | |
| Электрофотография | холестерики |
Нематические жидкие кристаллы оказались пригодными для контроля качества интегральных схем на разных стадиях изготовления. Принцип действия нематика основан на электрооптическом эффекте изменения текстуры нематика под действием электрического поля. На исследуемый слой наносится нематик, который накрывается стеклянной пластинкой с токопроводящим слоем. В случае целостности исследуемого слоя ориентация молекул нематика остается неизменной при подаче напряжения. При наличии дефектов (пор) электрическое поле меняет ориентацию нематика. Нематик − контролер позволяет определить не только размер дефекта и его характер (сквозная − несквозная пора или выступ на поверхности), но и имеющиеся обрывы металлизированного слоя (т. е. быстро и наглядно проверить работоспособность схемы).
В жидких кристаллах третьего класса при нагреве шаг спирали увеличивается, что меняет условия интерференции света на кристаллах и сопровождается изменением окраски отраженного света. В среднем длина волны отраженного света при нагреве на 1 °С уменьшается на 1-2 нм, что используют для регистрации и измерения стационарных и медленно меняющихся температурных полей. Эта область применения холестериков называется термографией. Контактная термография применяется для неразрушающего контроля различных изделий электронной техники: выпрямителей, интегральных и печатных схем, транзисторов. Дистанционная термография используется при изучении распределения интенсивности излучения ИК−лазеров и СВЧ−источников. Когда излучение попадает на подложку, она нагревается и жидкий кристалл дает двумерную картину распределения мощности, например, СВЧ−поля.
В последнее время на базе оптических и электрооптических свойств ЖК создается новый класс вычислительных машин − оптических. Для этих целей разрабатываются жидкокристаллические приборы передачи, отклонения, модуляции и разделения светового излучения. Перспективность холестерических ЖК как оптических материалов несомненна при создании лазеров для перестройки частоты излучения.
Дополнительные сведения:
| 402 | Температура плавления* | 1084,62 °C (1357,77 K, 1984,32 °F) |
| 403 | Температура кипения* | 2562 °C (2835 K, 4643 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,26 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 300,4 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,384 Дж/г·K (при 20 °C) |
| 410 | Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 7,1 см³/моль |
| 412 | Теплопроводность | 401 Вт/(м·К) (при стандартных условиях), 401 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 16,5 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,000000001 мм.рт.ст. (при 672°C), 0,00000001 мм.рт.ст. (при 727°C), 0,0000001 мм.рт.ст. (при 787°C), 0,000001 мм.рт.ст. (при 857°C), 0,00001 мм.рт.ст. (при 934°C), 0,0001 мм.рт.ст. (при 1025°C), 0,001 мм.рт.ст. (при 1133°C), 0,01 мм.рт.ст. (при 1264°C), 0,1 мм.рт.ст. (при 1419°C), 1 мм.рт.ст. (при 1617°C), 10 мм.рт.ст. (при 1910°C), 100 мм.рт.ст. (при 2312°C) |
| 420 | Давление паров (Па) | 1 Па (при 1509 K), 100 кПа (при 2834 K) |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело), 338 кДж/моль (при 298 К, для состояния вещества – газ) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 33,15 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), 166,3 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 424 | Стандартная мольная теплоемкость Cp | 24,4 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), |
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Кристаллическая решётка меди:
500
| Кристаллическая решётка | ||
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-50-8 |
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см 3 (при 0 °C и при нормальных условиях, состояние вещества – твердое тело).
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Источник
Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na + ) и отрицательных (Cl — ) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Кристаллическая решетка меди
Подскажите, как выглядит кристаллическая решетка меди? Охарактеризуйте валентные возможности атома меди (необходимо указать электронную формулу меди и число неспаренных электронов).
В виде простого вещества медь представляет собой металл красного цвета. Кристаллическая решетка меди гранецентрированная кубическая. Кристаллическая решетка представляет собой своего рода пространственный каркас, образованный пересекающимися прямыми линиями. В точках пересечения линий – узлах решетки – лежат центры частиц. Кристаллическая решетка меди – молекулярная. Это означает, что в её узлах находятся молекулы. Они связаны друг с другом межмолекулярными силами.
Рис. 1. Схематическое изображение кристаллической решетки меди.
Медь – металл, относится к элементам d-семейства. Электронная конфигурация меди выглядит следующим образом:
.
В кристаллах меди реализуется металлический тип химической связи. Металлической обычно называют связь между атомами металлов в твердом состоянии. В газовой фазе между атомами металлов имеет место обычная ковалентная неполярная связь. При образовании твердого вещества, так же как в любых кристаллах, образуются энергетические зоны – делокализованные молекулярные орбитали. В отличие от ионных кристаллов, энергетические зоны в металлических кристаллах значительно шире и даже могут перекрываться, что связано ч большой степенью перекрывания атомных орбиталей металлов и их высокими координационными числами.
Источник
Современные представления о строении вещества
Современная наука утверждает, что атом состоит из заряженного ядра, несущего положительный заряд, и электронов, несущих заряды отрицательные. Со скоростью несколько тысяч триллионов оборотов в секунду электроны вращаются по своим орбитам, создавая вокруг ядра электронное облако. Положительный заряд ядра численно равен отрицательному заряду электронов. Таким образом, атом вещества остается электрически нейтральным. Возможные взаимодействия с другими атомами происходят тогда, когда электроны отсоединяются от родного атома, тем самым нарушая электрический баланс. В одном случае атомы выстраиваются в определенном порядке, который и называется кристаллической решеткой. В другом – за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
1.1. Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в пространстве двумя способами:
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки
атомов в кристаллической решетке весьма велика.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок
), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (
дальний порядок
).
Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии
отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
Анизотропия кристаллов
Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны, а аморфные тела (стекло, смола) изотропны, т. е. имеют одинаковую плотность атомов в различных направлениях.
Анизотропия свойств важна при использовании монокристаллов
– одиночных кристаллов, частицы которых расположены единообразно по всему их объему. Монокристаллы имеют правильную кристаллическую огранку (в форме естественных многогранников), анизотропны по механическим, электрическим и другим физическим свойствам. Так, для монокристалла меди предел прочности σв изменяется от 120 до 360 МПа в зависимости от направления приложения нагрузки.
1.2. Основные типы кристаллических решеток
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ
). Такой тип структуры называется
металлической связью
.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
объемно-центрированная кубическая (ОЦК)
гранецентрированная кубическая (ГЦК)
гексагональная плотноупакованная (ГП)
(6 атомов на ячейку)
Рис. 1.2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2,б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с
параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с
/
а
всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметры а
кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой
а
лежит в пределах 0,228-0,398 нм, а
с
в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом
понимается количество ближайших соседей данного атома.
Рис. 1.3. Координационное число в различных кристаллических решетках для атома А:
В ОЦК решетке (рис. 1.3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К8).
В ГЦК решетке (рис. 1.3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов /,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам 5,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К12).
В ГПУ решетке при с/а =
1,633 (рис. 1.3, в) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов /,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
Кристаллическая структура меди (тип А).
В структурном типе меди кристаллизуются очень многие металлы: золото, серебро, никель, алюминий, кальций, торий, свинец, α-кобальт и др. Все эти металлы сравнительно мягкие, пластичные, легко обрабатываются. Многие из них образуют непрерывные ряды твердых растворов, например Аg-Аu, Сu-Аu. Структурой типа меди обладают также интерметаллические соединения: АuSb, Au2Bi, Аu2РЬ, Сu2 Мg, и др.
Элементарная ячейка меди—кубическая, гранeцентрированная (ГЦК) (рис. 7.11, а). Атомы располагаются в вершинах и центрах граней F-ячейки. На элементарную ячейку приходится 4 атома. Каждый атом окружен 12 ближайшими атомами, к. ч. = 12. Координационный многогранник — кубооктаэдр (рис. 7.11,б).
Плоскости зеркального отражения т
проходят параллельно грани элементарной ячейки и диагоналям граней (рис. 7.12). Пространственная группа
FтЗт.
В структуре имеется одна правильная система точек с кратностью 4. Координаты всех атомов в ячейке, т. е. базис: [[000]], [[1/2, 1/2, 1/2]], [[1/2, 0, 1/2]], [
| а | б |
| в | |
| Рис. 7.11 Структура меди: а — элементарная ячейка с выделенными злементарными трансляциями; б —две элементарные ячейки с выделенным координационным кубооктаэдром; в — положение октаэдричетких и тетраэдрическнх пустот |
Плотнейшие слои перпендикулярны осям 3,
т. е. направлениям ; каждый атом в слое окружен шестью атомами. Эти слои сочетаются между собой тоже плотнейшим образом: атом одного слоя ложится в лунку между тремя атомами предыдущего слоя. Плотнейшая упаковка—кубическая, трехслойная
АВСАВС. .
Все пустоты между шарами не заполнены (рис. 7.11,в). Центры октаэдрических пустот находятся на серединах ребер и в центре кубической элементарной ячейки, а центры тетраэдрических пустот—в серединах каждого из восьми октантов, на которые мысленно можно разделить кубическую ячейку.
Дата добавления: 2015-08-21 ; ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
1.3. Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.
Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ
обозначается цифрами 100 (рис. 1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX,
OY
и
OZ
соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY
и
OZ
обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней
XOZ, XOY
и
YOZ
обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Индексами плоскостей, параллельных плоскостям XOZ
и
YOZ,
окажутся выражения (010) и (100) (рис. 1.4, б). Индекс вертикальной диагональной плоскости куба выразится через (110), (рис. 1.2, в), а индекс наклонной плоскости, пересекающейся со всеми тремя осями координат на удалении одного параметра, примет вид (111) (см. рис. 1.4, г).
Виды кристаллических решёток
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками. Места, в которых находятся сами молекулы, ионы или атомы, называют узлами. А расстояния между узлами получили название – периоды идентичности. В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
1.4. Анизотропия в кристаллах
Под анизотропией
понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в) по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
Рис. 1.5. Элементарная ячейка решетки ОЦК
Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
Рис. 1.6. Плоскости решетки ОЦК
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
1.5. Аллотропия металлов
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии
или
полиморфизма
, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии
F
от температуры
t
для двух вариантов кристаллического строения железа: ОЦК (кривая
1
) и ГЦК (кривая
2).
В интервале температур 911-1392 о C железо имеет решетку ГЦК, так как при этом его свободная энергия меньше. При t 1392°С, у него должна быть решетка ОЦК, обладающая меньшей свободной энергией.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Me — ne⁻ ⇆ Me
,
здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K — e⁻ ⇆ K;
- Cu — 2e⁻ ⇆ Cu;
- Al — 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
1.6. Дефекты кристаллической решетки металла
Кристаллическая решетка, в которой отсутствуют нарушения сплошности и все узлы заполнены однородными атомами называется идеальной кристаллической решеткой металла.
В решетке реального металла могут находиться различные дефекты.
Все дефекты кристаллической решетки принято делить на точечные, линейные, поверхностные и объемные.
Точечные дефекты соизмеримы с размерами атомов. К ним относятся вакансии, т. е. незаполненные узлы решетки, межузельные атомы данного металла (рис 1.8), примесные атомы замещения, т. е. атомы, по диаметру соизмеримые с атомами данного металла и примесные атомы внедрения, имеющие очень малые размеры и поэтому находящиеся в междоузлиях (рис 1.9). Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Рис. 1.8. Схема образования пары вакансия-внедренный атом
Рис. 1.9. Примесные атомы внедрения и замещения
Линейные дефекты имеют длину, значительно превышающую их поперечные размеры. К ним относятся дислокации
, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей.
Дислокации бывают двух видов.
Наиболее характерной является краевая дислокация
(рис. 1.10). Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости.
Рис. 1.10. Схема краевой дислокации в идеальном кристалле
Нижний ряд экстраплоскости собственно и принято называть дислокацией.
Другим типом дислокации является винтовая дислокация
, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости (рис.1.11).
Рис. 1.11. Схема винтовой дислокация
В винтовой дислокации, так же как в краевой, существенные искажения кристаллической решетки наблюдаются только вблизи оси, поэтому такой дефект может быть отнесен к линейным.
Дислокации обладают высокой подвижностью, поэтому существенно уменьшают прочность металла, так как облегчают образование сдвигов в зернах-кристаллитах под действием приложенных напряжений.
Дислокационный механизм сдвиговой пластической деформации
внутри кристаллов может привести к разрушению изделия. Таким образом, дислокации непосредственно влияют на прочностные характеристики металла.
На рис. 1.12 в виде кривой ABC
схематически показана зависимость прочности металла от плотности дислокаций. Точка
А
соответствует теоретической прочности металла, обусловленной необходимостью одновременного разрыва всех межатомных связей, проходящих через плоскость сдвига, в случае отсутствия дислокаций.
При увеличении количества дислокаций (см. участок АВ)
прочность резко снижается, так как на несколько порядков уменьшаются усилия, необходимые для осуществления сдвигов в зернах металла при его деформировании и разрушении.
Рис. 1.12. Зависимость предела прочности кристалла от плотности линейных дефектов(дислокаций). Кривая Одинга
При плотности дислокаций 10 6- 10 7 см-2 (точка В
на кривой), прочности минимальна, и на участке
ВС
происходит ее рост. Это объясняется тем, что с ростом плотности дислокаций их передвижение происходит не только по параллельным, но и по пересекающимся плоскостям, что существенно затрудняет процесс деформирования зерен.
Поэтому начиная с точки В
прочность металла возрастает.
Поверхностные дефекты
включают в себя главным образом границы зерен (рис.1.13). На границах кристаллическая решетка сильно искажена. В них скапливаются перемещающиеся изнутри зерен дислокации.
Из практики известно, что мелкозернистый металл прочнее крупнозернистого. Так как у последнего меньше суммарная протяженность (площадь) границ. То можно сделать вывод, что поверхностные дефекты способствуют повышению прочности металла. Поэтому создано несколько технологических способов получения мелкозернистых сплавов.
Рис.1.13. Структура границы двух соседних кристаллических зерен
Объемные дефекты
кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.
Что такое медь? Свойства, история и происхождение меди
История меди
Добрый день, уважаемый читатель, в данной статье хочу рассказать о меди и её свойствах. Что такое медь? Ответ на этот вопрос знают почти все. Она имеет обозначение Cu (произносится купрум) в таблице В. И. Менделеева находится под атомным номером 29. Медь – химический элемент, представляет собой металл. Название меди Cuprum является латинским и происходит от названия острова Кипр.
Данный металл широко применяется человеком уже долгие годы. Имеются достоверные факты о том, что индейцы, жившие в Эквадоре уже в XV веке умели добывать и использовать медь. Из неё они изготовляли монеты в виде топориков.
Данная монета очень продолжительное время являлась единственным денежным знаком, который существовал на побережье Южной Америки. Эта монета даже использовалась в торговле с инками. На острове Кипр, в III веке до нашей эры уже были открыты медные рудники. Известен интересный факт, что древние алхимики называли медь — венера (Venus).
Происхождение меди
Медь в природе встречается либо в самородках, либо в соединениях. Особое значение в промышленности имеют халькозин, борнит и медный колчедан. Однако и такие популярные в ювелирном деле поделочные самоцветы, как лазурит и малахит практически на сто процентов состоят из меди.
Медь имеет золотисто – розовую окраску. На воздухе этот металл очень быстро окисляется и покрывается оксидной плёнкой, которая называется патина. Именно из-за патины медь приобретает желтовато – красный цвет. Этот металл входит в состав очень многих сплавов, которые широко используются в промышленности.
Распространённые сплавы меди
Самым известным сплавом является дюралюминий, который состоит из сплава меди и алюминия. Медь в дюралюминии играет главную роль. Мельхиор также содержит медь в соединении с никелем, бронза – соединение олова и меди, латунь – сплав меди с цинком.
Медь обладает довольно высокой тепло и электропроводностью. По сравнению с другими металлами, она занимает второе место после серебра по электропроводности. В ювелирном производстве часто используют сплавы золота с медью. Медь в данном сплаве нужна для увеличения прочности ювелирных украшений к деформациям и истиранию.
В давние времена был известен сплав меди с оловом и цинком, который назывался пушечный металл. Как вы уже, наверно, догадались, что из данного сплава изготавливали пушечные ядра, но с развитием новых технологий, пушки перестали использовать и выпускать, однако данный сплав по сей день используется в производстве оружейных гильз.
Медь имеет бактерицидные свойства и поэтому она широко применяется в медицине, которые очень часто применяются в медицине. Данный факт доказан научными экспериментами и исследованиями. Особенно хорошо медь противостоит золотистому стафилококку. Этот микроб вызывает большое количество гнойных заболеваний кожи.
Токсичность меди
В тоже время известны факты того, что медь бывает очень токсичной. На планете Земля существует озеро Беркли Пит, оно находится в США в штате Монтана. Так вот это озеро считается самым токсичным в мире. Причиной тому является медный рудник, на месте которого образовалось озеро.
Вода в озере очень токсична, в ней почти нет живых организмов, а глубина озера составляет более 0,5 километра. Сильную токсичность воды доказывает один пример, который произошёл однажды на озере. Стая диких гусей, состоявшая из 35 взрослых особей, опустилась на водную гладь озера, а через 2,5 часа все птицы были найдены погибшими.
Однако, совсем недавно, на дне озера были обнаружены совсем новые микроорганизмы и водоросли, которые не встречались ранее в природе. В результате мутаций, данные жители хорошо себя чувствуют в токсичной воде озера.