Поговорим о твердых телах. Твердые тела можно разделить на две большие группы: аморфные и кристаллические. Разделять мы их будем по принципу есть порядок или нет.
В аморфных веществах молекулы располагаются хаотично. В их пространственном расположении нет никаких закономерностей. По сути, аморфные вещества – это очень вязкие жидкости, настолько вязкие, что твердые.
Отсюда и название: «а-» – отрицательная частица, «morphe» – форма. К аморфным веществам относятся: стекла, смолы, воск, парафин, мыло.
Отсутствие порядка в расположении частиц обусловливает физические свойства аморфных тел: они не имеют фиксированных температур плавления. По мере нагревания их вязкость постепенно снижается, и они также постепенно переходят в жидкое состояние.
В противоположность аморфным веществам существуют кристаллические. Частицы кристаллического вещества пространственно упорядочены. Это правильная структура пространственного расположения частиц в кристаллическом веществе называется кристаллической решеткой.
В отличии от аморфных тел, кристаллические вещества имеют фиксированные температуры плавления.
В зависимости от того какие частицы находятся в узлах решетки, и от того какие связи удерживают их различают: молекулярную, атомную, ионную и металлическую решетки.
Для чего принципиально важно знать, какая у вещества кристаллическая решетка? Что она определяет? Все. Структура определяет, как химические и физические свойства вещества.
Самый простой пример: ДНК. У всех организмов на земле она построена из одинакового набора структурных компонентов: нуклеотидов четырех видов. А какое многообразие жизни. Это все определяется структурой: порядком, в котором эти нуклеотиды расположены.
Определение
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Атомы и молекулы
Любые тела и предметы состоят из молекул — мелких частиц, на которые можно раздробить вещество физическими методами (например, растворением). Из этого вытекает определение молекулы: это самая мелкая частица вещества, сохраняющая его химические свойства.
Атомы — это мельчайшие частицы, сохраняющие свойства химического элемента, из них составляются молекулы. Атомы выделяются из молекул химическими методами.
Химические вещества могут быть газообразными, жидкими и твердыми. Частицы твердых веществ расположены ближе, а газов — дальше друг от друга, и они находятся в постоянном движении. Чем выше температура тела, тем быстрее движение молекул и атомов в нем, называемое броуновским, и тем больше расстояние между частицами. Внутри этого «бульона» постоянно действуют силы взаимного притяжения и отталкивания частиц, которые выражены тем сильнее, чем меньше разделяющее их расстояние.
Виды решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
Металлическаякристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO
2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
- небольшая твердость;
- низкая прочность;
- легкоплавкость;
- летучесть;
- у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH
3, гелий He, радон Rn, йод I, азот
N
2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.
зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Категории ОБЩАЯ ХИМИЯ, Химическая связь и строение молекул Метки металлическая кристаллическая решетка, металлическая связь, свободнодвижущиеся электроны
Атомная решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
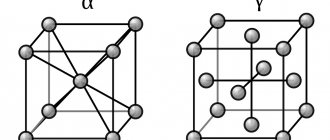
Металлическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллическое и аморфное вещество
Кристаллическое вещество: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
Аморфное вещество: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.
Кристаллическая структура Аморфная структура
Сейчас мы будем рассматривать только кристаллические вещества.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
Типы кристаллических решеток
| Тип кристаллической решетки | Частицы в узлах решетки | Характеристики | Вещества | тип связи |
| Молекулярная | Молекулы | Не прочный, низкая Тпл(температура плавления), летучие | Благородные газы: Ne, Ar … Галогены: F2, Cl2 Галогеноводороды: HF, HCl … Простые вещества неметаллы: О2, Н2, N2, P(белый) Оксиды и водородные соединения неметаллов: SO2, CO2, NH3, PH3 | Ковалентная (полярная и неполярная) |
| Ионная | Ионы | Прочная, Высокая Тпл, Нелетучие, Расплавы и растворы проводят эл.ток | Соли, оксиды и гидроксиды металлов | Ионная |
| Металлическая | Атомы и ионы | Пластичные Электро- и теплопроводные | Металлы и сплавы | Металлическая |
| Атомная | Атомы | Очень прочная, Очень высокие Тпл | С (алмаз, графит), Si ,Ge, B, SiO2(кремнезем, кварц) Al2O3 CaC2, SiC (карборунд), BN, Fe3C, P черный и красные | Ковалентная |
Ионные кристаллы
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь. Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
Видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – Crystal Lattice in Chemistry.