Химические свойства щелочных металлов: взаимодействие, получение
Щелочные металлы находятся в первой группе периодической таблицы. Атомы этих элементов содержат один электрон на внешнем энергетическом уровне. Он расположен на большом расстоянии от ядра. Как и все металлы являются восстановителями и легко отдают электрон. Характерна степень окисления равная +1. В группе сверху вниз наблюдается увеличение металлических свойств. За счет растущей энергии ионизации способность отдавать электроны, а следовательно, электроотрицательность возрастают снизу вверх.
Франций является самым активным металлом, так как у него электрон находится на самом далеком расстоянии от ядра. Соответственно, его способность к восстановлению самая высокая.
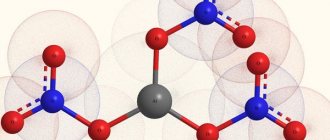
- В нормальных условиях щелочные металлы взаимодействуют с кислородом. Они очень активны в таких реакциях, поэтому их хранят под слоем вазелинового масла. Продукты реакции могут быть оксидами или пероксидами.
4Li + O2 → 2Li2O 2Na + O2 → Na2O2 - Щелочные металлы вступают с водой в реакцию при нормальных условиях. Водород вытесняется из воды, и в качестве продукта реакции образуется растворимое основание – щелочь. Для распознавания щелочи можно использовать индикатор — фенолфталеин. При добавлении в раствор он окрашивается в малиновый цвет. Реакции с водой протекают очень бурно, литий «взрывается» в воде, натрий «кипит». При этом водород выделяется в виде белого пара клубами.
2Na + 2H2O → 2NaOH + H2↑ 2Li + 2H2O → 2LiOH + H2↑ - Вступают в реакции с галогенами, образуя галогениды.
2K + Cl2 → 2KCl 2Na + Cl2 → 2NaCl - Характерно взаимодействие с водородом при нагревании, продуктом реакции являются гидриды. Например, продуктом реакции калия и водорода будет гидрид калия.
H2↑ + 2K → 2KH - С серой при нагревании образуют сульфиды. Это твердое, бесцветное вещество, растворимое в воде.
2Na + S → Na2S - При нагревании происходит реакция с фосфором, фосфиды являются продуктом.
3K + P → K3P - Литий и натрий могут вступать в реакцию с углеродом при нагревании. В результате образуются карбиды. Остальные щелочные металлы в эти реакции не вступают.
2Li + 2C → Li2C2 - С азотом при обычных условиях реагирует только литий, с остальными щелочными металлами реакция возможна только при нагревании.
6Li + N2 → 2Li3N - Взаимодействуют со спиртами, образуя алкоголяты.
2C2H5OH + 2Na = 2C2H5ONa + H2↑Многие щелочные металлы способны взаимодействовать с разбавленными кислотами до образования водорода. Однако, реакция протекает стадийно, т.е. сначала металл реагирует с водой до образования щелочи, а затем происходит нейтрализация щелочи кислотой. Взаимодействие с кислотами сопровождается взрывом и поэтому такие реакции на практике не проводятся.
Получение
- Основным методом получения щелочных металлов является электролиз галогенидных расплавов. При этом чаще всего используются хлориды, входящие в состав природных минералов.
- Другими способами получения щелочных металлов могут быть получение из его оксидов и солей.
Например, натрий можно получить путем кальцинирования соды с углем.Na2CO3 + 2C → 2Na + 3CO↑
Литий получают из его оксида при повышении температуры до 300°С.
2Li2O + Si + 2CaO → 4 Li + Ca2SiO4
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.
Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
- Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
Система охлаждения из меди на тепловых трубках в ноутбуке
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.
Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.
Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
- 25% – розовый;
- 50% – красный.
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.
Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Химические свойства щелочноземельных металлов: взаимодействие, получение
Главную подгруппу второй группы периодической системы химических элементов образуют металлы, которые получили название щелочноземельных.
Так названы они потому, что гидраты их окислов («земель»), подобно гидратам окислов щелочных металлов, являются щелочами.
Внешний электронный слой их атомов состоит из двух электронов. Отдавая их, атомы этих металлов превращаются в ионы, несущие две единицы положительного заряда. Во всех своих соединениях металлы подгруппы бериллия положительно двухвалентны. В периодической таблице они соседствуют с щелочными металлами. Поэтому эти элементы проявляют высокую химическую активность, уступая в ней только щелочным металлам. Свойства металла повышаются с увеличением порядкового номера.
- Вступают в реакции с кислородом, продуктом реакции становятся оксиды, исключение барий, он образует пероксид BaO2. Бериллий и магний взаимодействуют с кислородом только при очень высоких t, так как покрыты тонкой защитной оксидной пленкой.
2Ca + O2 → 2CaOВ приведенной выше реакции кусочек кальция сгорает с образованием белого дыма при нагревании. Он образован тончайшими твердыми частицами оксида кальция.
- Подобно щелочным металлам взаимодействуют с водой, но менее активно. В результате образуется гидрат оксида и вытесняется водород.
Ca + 2H2O → 2Ca(OH)2 + H2↑Фенолфталеин окрашивается в полученном растворе в малиновый цвет. Этот пример оправдывает ожидаемое сходство в химических свойствах щелочноземельных и щелочных металлов: оба взаимодействуют с водой с выделением водорода. Гидраты оксидов щелочноземельных металлов, как и щелочи, являются щелочами, то есть они растворимы в воде.
- Все металлы, кроме бериллия, вступают в реакцию с галогенами. Бериллий взаимодействует с галогенами только при повышенных температурах. Продуктом реакции являются галогениды.
Ca + Cl2 → CaCl2 - При нагревании с водородом реагируют все щелочноземельные металлы, кроме бериллия. В результате образуются гидриды.
Ca + H2 → CaH2 - Реагируют с серой, в результате чего образуются сульфиды.
Ca + S → CaS - Взаимодействуют с азотом при нагревании, за исключением магния. Он реагирует с азотом в нормальных условиях. Продуктом реакции являются нитриды.
3Be + N2 → Be3N2 3Mg + N2 → Mg3N2
- Могут вступать в реакции с кислотами, в результате образуют соли соответствующей кислоты и водород.
Be + H2SO4 (разб.) → BeSO4 + H2↑
Получение
Основными способами получения металлов второй группы главной подгруппы являются электролиз расплавов, алюминотермия и вытеснение из их солей другими более активными металлами.
CaO + Al → Al2O3 + Ca
MgBr2 + Ca → CaBr2 + Mg
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Химические свойства алюминия
Алюминий находится в третьей группе периодической системы элементов. Заряд ядра атома алюминия +13, на внешнем электронном слое три электрона.
По строению атомов и положению в периодической системе можно предположить, что у элементов третьей группы металлические свойства должны быть выражены слабее, чем у элементов второй группы. Это действительно так.
При химических реакциях атом алюминия отдает три электрона внешнего слоя, обращаясь в трех зарядный положительный ион Al3+. Поэтому во всех его устойчивых соединениях алюминий положительно трехвалентен. Его соединения проявляют амфотерные свойства.
Алюминий – химически активный металл и проявляет себя как восстановитель. Однако его активность снижает оксидная пленка, которая образуется на его поверхности. Поэтому во многих реакциях пленка сначала удаляется, а затем осуществляется взаимодействие с веществами. Рассмотрим на конкретных примерах химические свойства алюминия.
- Алюминий соединяется с кислородом воздуха и при нагревании и при обыкновенной температуре. На его поверхности быстро образуется тончайшая плотная пленка окиси алюминия. Она трудно проницаема для газов и защищает металл от дальнейшего окисления.
В раздробленном состоянии и при повышенной температуре алюминий бурно реагирует с кислородом с выделением большого количества тепла. В результате образуется окись алюминия.4Al + 3O2 → 2Al2O3
- Со многими неметаллами реакции происходят при нагревании.
2Al + 3S → Al2S3 Al + P → AlP 2Al + N2 → 2AlN 4Al + 3C → Al4C3 - С водой взаимодействует при удалении оксидной пленки. Реакция протекает энергично, вытесняя водород из воды.
2Al + 6H2O → 2Al(OH)3↓ + 3H2 - Взаимодействие с кислотами. Опустим алюминиевые стружки в пробирку с соляной или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль.
2Al + 6HCl → 2AlCl3 + 3H2↑ 2Al +3H2SO4(разб.)→ Al2(SO4)3 + 3H2↑С концентрированной азотной и серной кислотой не реагирует. Поэтому концентрированная азотная кислота хранится в алюминиевых емкостях и транспортируется в алюминиевых резервуарах.
С разбавленной азотной кислотой вступает в реакцию с образованием
N2O, N2 или NH4NO3. 8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
- Поскольку алюминий обладает амфотерными свойствами, он характеризуется реакциями со щелочами.
2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2↑ - Алюминий взаимодействует с окислами большинства металлов, вытесняя менее активный металл. Этот метод используется в промышленности для получения металлов и называется алюминотермией.
2Al + Fe2O3 → 2Fe + Al2O3
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.