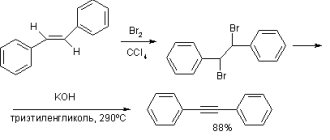
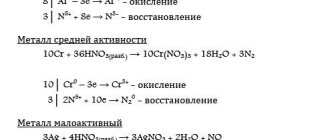Краткая характеристика оксида алюминия:
Оксид алюминия – неорганическое вещество, не имеющее цвета.
Оксид алюминия содержит три атома кислорода и два атома алюминия.
Химическая формула оксида алюминия Al2O3.
В природе встречается в виде глинозема и корунда.
В воде не растворяется.
Амфотерный оксид. Проявляет в зависимости от условий либо основные, либо кислотные свойства. Свои химические свойства проявляет будучи разогретым до высоких температур- порядка 1000 оС.
Химическое пассивирование алюминия
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия — 660 °C.
Плотность алюминия — 2,6989 г/см3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 → 2Al2O3.
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок.
При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм.
При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т.п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2↑.
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
2Al + 3H2SO4(разб) → Al2(SO4)3 + 3H2↑.
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
2Al + 6H2SO4(конц) → Al2(SO4)3 + 3SO2↑ + 6H2O.
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
2Al + 6HCl → 2AlCl3 + 3H2↑.
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Al + 6HNO3(конц) → Al(NO3)3 + 3NO2↑ + 3H2O.
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2(NaOH•H2O) + 2Al → 2NaAlO2 + 3H2↑.
Образуются алюминаты.
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
Пассивация и уход за нержавеющей сталью пивоваренного оборудования
Несмотря на свою идеальную репутацию в качестве металла для производства пива, нержавеющая сталь может вызвать коррозию или ржавчину. Поэтому на этой неделе мы взглянем на то, как и почему нержавеющая сталь может корродировать, а также, как вы сможете пассивировать свою нержавеющую сталь пивоваренного оборудования для ее защиты.
Нержавеющая сталь и ржавчина
Сталь изготавливается из сплава железа и углерода, а углерод составляет всего лишь пол или чуть более процента в ее составе. Для сравнения, нержавеющая сталь производится из железа и хрома. Хрома же содержится примерно 10-30% в составе стали, и он является важным элементом, который делает нержавеющую сталь устойчивой к коррозии.
Хром в нержавеющей стали очень быстро реагирует с кислородом, и фактически образует защитный слой оксида хрома на поверхности стали. Этот оксид хрома предотвращает образование ржавчины и коррозии. Однако, если слой хрома по какой-либо причине нарушится, то железо в сталь могут фактически начать корродировать и ржаветь.
Физические свойства оксида алюминия*:
| Наименование параметра: | Значение: |
| Химическая формула | Al2O3 |
| Синонимы и названия на иностранном языке | aluminum oxide α-form (англ.) corundum (англ.) алюминия окись α-форма (рус.) корунд (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные тригональные кристаллы |
| Цвет | из-за примесей оксид алюминия, как минерал, может быть окрашен в разные цвета |
| Вкус | —** |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3990 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,99 |
| Температура кипения, °C | 3530 |
| Температура плавления, °C | 2050 |
| Молярная масса, г/моль | 101,96 |
| Твердость по шкале Мооса | 9 |
Примечание:
* оксида алюминия α-формы.
** — нет данных.
Химические свойства
- При растворении в воде подвергается гидролизу:
Al(NO3)3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3 NO3− [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+ Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7. При нагревании гидролиз можно провести полностью: Al(NO3)3 + 3 H2O = Al(OH)3 ↓ + 3 HNO3 ↑
- Вступает в реакцию со щелочами:
Al(NO3)3 + 3 NaOH = Al(OH)3 ↓ + 3 NaNO3 Al(NO3)3 + 4 NaOH = Na[Al(OH)4] + 3 NaNO3 Реакция с концентрированным водным раствором аммиака может идти по двум направлениям. На холоде: Al(NO3)3 + 3 NH3 + 3 H2O = Al(OH)3 ↓ + 3 NH4NO3 При нагревании: Al(NO3)3 + 3 NH3 + 3 H2O = AlO(OH) ↓ + 3 NH4NO3 + H2O
- При нагревании разлагается:
4 Al(NO3)3 = 2 Al2O3 + 12 NO2 ↑ + 3 O2 ↑ Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Химические свойства оксида алюминия. Химические реакции оксида алюминия:
Оксид алюминия относится к амфотерным оксидам.
Химические свойства оксида алюминия аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида алюминия с алюминием:
4Al + Al2O3 ⇄ Al2О (t = 1450 °C).
В результате реакции образуется оксид алюминия.
2. реакция оксида алюминия с углеродом:
2Al2O3 + 9С → 2Al4С3 + 6CО (t = 1800 °C).
В результате реакции образуется соль – карбид алюминия и оксид углерода.
3. реакция оксида алюминия, углерода и азота:
Al2O3 + 3С + N2 → 2AlN + 3CО (t = 1600-1800 °C).
В результате реакции образуется соль – нитрид алюминия и оксид углерода.
4. реакция оксида алюминия с оксидом натрия:
Na2О + Al2O3 → 2NaAlО2 (t = 2000 °C).
В результате реакции образуется соль – алюминат натрия.
5. реакция оксида алюминия с оксидом калия:
K2О + Al2O3 → 2KAlО2 (t = 1000 °C).
В результате реакции образуется соль – алюминат калия.
6. реакция оксида алюминия с оксидом магния:
MgО + Al2O3 → MgAl2О4 (t = 1600 °C).
В результате реакции образуется соль – алюминат магния (шпинель).
7. реакция оксида алюминия с оксидом кальция:
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C).
В результате реакции образуется соль – алюминат кальция.
8. реакция оксида алюминия с оксидом азота:
Al2O3 + 3N2О5 → 2Al(NO3)3 (t = 35-40 °C).
В результате реакции образуются соль – нитрат алюминия.
9. реакция оксида алюминия с оксидом кремния:
Al2O3 + SiО2 → Al2SiО5.
В результате реакции образуется соль – силикат алюминия. Реакция протекает при спекании реакционной смеси.
10. реакция оксида алюминия с гидроксидом натрия:
Al2O3 + 2NaOH → 2NaAlO2 + H2О (t = 900-1100 oC).
Сплавление оксида алюминия с сухим гидроксидом натрия. В результате реакции образуется соль – алюминат натрия и вода.
11. реакция оксида алюминия с гидроксидом калия:
Al2O3 + 2KOH → 2KAlO2 + H2О (t = 900-1100 oC).
Сплавление оксида алюминия с сухим гидроксидом калия. В результате реакции образуется соль – алюминат калия и вода.
12. реакция оксида алюминия с карбонатом натрия:
Al2O3 + Na2СO3 → 2NaAlO2 + СО2 (t = 1000-1200 oC).
В результате реакции образуется соль – алюминат натрия и оксид углерода.
13. реакция оксида алюминия с плавиковой кислотой:
Al2O3 + 6HF → 2AlF3 + 3H2O (t = 450-600 oC).
В результате химической реакции получается соль – фторид алюминия и вода.
14. реакция оксида алюминия с азотной кислотой:
Al2O3 + 6HNO3 → 2Al(NO3)2 + 3H2O.
В результате химической реакции получается соль – нитрат алюминия и вода.
Аналогично проходят реакции оксида алюминия и с другими кислотами.
15. реакция оксида алюминия с бромистым водородом (бромоводородом):
Al2O3 + 6HBr → 2AlBr3 + 3H2O.
В результате химической реакции получается соль – бромид алюминия и вода.
16. реакция оксида алюминия с йодоводородом:
Al2O3 + 6HI → 2AlI3 + 3H2O.
В результате химической реакции получается соль – йодид алюминия и вода.
17. реакция оксида алюминия с аммиаком:
Al2O3 + 2NH3 → 2AlN + 3H2O (t = 1000 oC).
В результате химической реакции получается соль – нитрид алюминия и вода.
18. реакция электролиза оксида алюминия:
2Al2O3 → 4Al + 3О2 (t = 900 oC).
Электролиз проводят в расплаве. В результате химической реакции получается алюминий и кислород.
Пассивация алюминия азотной кислотой
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s22s22p63s23p1. Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне.
В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3.
Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
4Аl + 3О2 = 2Аl2О3
с галогенами
Алюминий очень энергично реагирует со всеми галогенами.
Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
2Al + 3I2 =2AlI3
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
2Al + 3Br2 = 2AlBr3
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
2Al + 3Cl2 = 2AlCl3
с серой
При нагревании до 150-200 оС или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 oC образуется нитрид алюминия:
с углеродом
При температуре около 2000oC алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде.
При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция.
Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС.
В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
а) 2Аl + 3Н2SO4(разб.) = Аl2(SO4)3 + 3H2↑
2Аl0 + 6Н+ = 2Аl3+ + 3H20;
б) 2AI + 6HCl = 2AICl3 + 3H2↑
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией.
При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях.
Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(разб.) = 8Al(NO3)3 +3N2O↑ + 15H2O
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Пассивирование металла: назначение, технология, методы
Несмотря на то, что нержавеющая сталь отличается высокой устойчивостью к коррозии, дополнительная защита, которую позволяет получить такая технологическая операция, как пассивация, для нее желательна. В отдельных случаях, когда большому риску развития коррозии подвержены даже изделия, изготовленные из нержавеющей стали, необходимость в выполнении такой процедуры не вызывает сомнений.
Примеры нержавеющих поверхностей, подвергнутых коррозии, и результаты проведенной пассивации
Чем обусловлена высокая коррозионная устойчивость нержавеющих сталей
Суть такого явления, как коррозия, состоит в том, что поверхность металла под воздействием негативных внешних факторов и окружающей среды начинает разрушаться.
Что характерно, коррозия из-за постоянного окисления поражает металл слой за слоем, постепенно разрушая внутреннюю структуру стали.
Во многих случаях локализовать пораженные участки внутренней структуры металла уже не имеет смысла, поэтому стальные изделия приходится заменять на новые.
Пассивирование (или пассивация) как технология, позволяющая обеспечить надежную защиту стали от коррозии, лежит в основе создания такого уникального металла, каким является нержавеющая сталь. В химическом составе преимущественного большинства сталей, относящихся к нержавеющей категории, могут содержаться различные элементы:
- никель;
- молибден;
- кобальт;
- ниобий;
- марганец.
Однако основным легирующим элементом таких сталей, количество которого в их составе может варьироваться в пределах 12–20%, является хром.
Добавление различных легирующих элементов в состав нержавеющих сталей позволяет придать им требуемые физико-химические характеристики, но именно хром отвечает за коррозионную устойчивость стального сплава.
Влияние хрома на свойства нержавеющей стали
Нержавеющие стальные сплавы, в составе которых содержится 12% хрома, проявляют высокую коррозионную устойчивость только при взаимодействии с окружающим воздухом.
Если количество хрома в химическом составе нержавеющей стали увеличить до 17%, то изделия из нее смогут спокойно взаимодействовать с азотной кислотой, не утрачивая при этом своих эксплуатационных характеристик.
Чтобы сделать металл устойчивым к еще более агрессивным средам, к числу которых относятся соляная, серная и другие кислоты, в нем не только увеличивают количественное содержание хрома, но и добавляют в его состав такие элементы, как медь, молибден, никель и др. Иными словами, выполняют пассивирование металла, то есть увеличивают его пассивность к коррозионным процессам.
В процессе пассивации зоны сварочного шва образуется прочная пленка
Пассивация, при которой в химический состав нержавеющей стали добавляют соответствующие легирующие элементы, – это не единственное условие высокой коррозионной устойчивости металла.
Чтобы защитные свойства нержавеющей стали оставались на высоком уровне, оксидная пленка на ее поверхности, состоящая преимущественно из оксида хрома, должна быть целой, иметь однородный химический состав и толщину.
Причины возникновения коррозии
Несмотря на то, что в химическом составе нержавеющей стали должны содержаться пассиваторы, значительно повышающие ее коррозионную устойчивость, ее поверхность и внутренняя структура могут подвергаться коррозии.
Основной причиной, по которой нержавеющая сталь начинает разрушаться, является недостаточное или неравномерное содержание в ее химическом составе хрома.
Получение гидроксида алюминия:
Гидроксид алюминия получают в результате следующих химических реакций:
- 1. в результате взаимодействия хлорида алюминия и гидроксида натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка.
- 2. в результате взаимодействия хлорида алюминия, карбоната натрия и воды:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 6NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии водорастворимых солей алюминия с карбонатами щелочных металлов.
Химическая формула и свойства соединения
Условными обозначениями формула нитрата алюминия выглядит следующим образом:Аl(NО3)3. Это соединение обладает следующими параметрами:
- • пребывает в твердом агрегатном состоянии при нормальных условиях;
- • молярная масса составляет 212,996 грамм на моль;
- • плотность равняется 1,89 грамм на кубический сантиметр;
- • плавится вещество всего при 66 градусах по Цельсию;
- • массовая доля азота в нитрате алюминия составляет 19,7%;
- • в химических реакциях проявляет высокую активность, которая увеличивается при нагревании до определенного уровня, так как дальше начинается разложение.
Нитрат алюминия 3 можно получить несколькими способами, которые дают одинаково хороший результат, а отличаются лишь необходимостью наличия разных компонентов:
1. Самым простым способом будет растворение или так называемое травление чистого металла в разведенной азотной кислоте: 8Аl+30НNО3=8Аl(NО3)3+3N2О+15Н2О.
2. Также можно осуществлять воздействие азотной кислотой на основание алюминия: Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
3. Можно проводить реакцию замещения, для чего используются менее активные металлы, которые вытесняются алюминием: Аl2(SО4)3+3BА(NО3)2=2Аl(NО3)3+3BАSО4.
4. Чтобы сразу получить безводный раствор, нужно провести реакцию кристаллогидрата, которая может иметь два вида взаимодействий:
- • Аl(ОН)3·9Н20+9N2О5=Аl(NО3)3+18НNО3;
- • АlCl3+3ClNО3=Аl(NО3)3+3Cl2.
5. В промышленности твердое вещество также получают двумя основными методами:
- • Аl2О3+3N2О5=2Аl(NО3)3;
- • Аl(ОН)3+3N2О5=Аl(NО3)3+3НNО3.
6. Можно применять в качестве исходного сырья бромид алюминия, тогда реакция будет протекать постепенно в две стадии:
- • вначале идет поляризация: 2АlBr3+8N2О5=2[NО2]-[Аl(NО3)4]++3Br2+6NО2.
- • а затем реакция завершается: 2[NО2]-[Аl(NО3)4]+=2Аl(NО3)3+4N2О+О2.
Как видно, раствор нитрата алюминия и твердое вещество можно получить большим количеством способов, причем для этого даже не потребуются специальные условия.