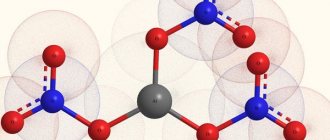
Химическое соединение с формулой Al2O3
Эта статья про оксид алюминия (III), Al2О3. Для использования в других целях см. Оксид алюминия (соединения).
Оксид алюминия (Оксид алюминия)
| Идентификаторы | |
| Количество CAS |
|
| 3D модель (JSmol) |
|
| ЧЭМБЛ |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.014.265 |
| Номер ЕС |
|
| PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
| Панель управления CompTox (EPA) |
|
ИнЧИ
| |
Улыбки
| |
| Свойства | |
| Химическая формула | Al2О3 |
| Молярная масса | 101.960 г · моль−1 |
| Внешность | белое твердое вещество |
| Запах | без запаха |
| Плотность | 3,987 г / см3 |
| Температура плавления | 2072 ° С (3762 ° F, 2345 К)[3] |
| Точка кипения | 2977 ° С (5391 ° F, 3250 К)[4] |
| Растворимость в воде | нерастворимый |
| Растворимость | не растворим во всех растворителях |
| журнал п | 0.31860[1] |
| Магнитная восприимчивость (χ) | −37.0×10−6 см3/ моль |
| Теплопроводность | 30 Вт · м−1· K−1[2] |
| Показатель преломления (п D) | пω=1.768–1.772 пε=1.760–1.763 Двулучепреломление 0.008 |
| Структура | |
| Кристальная структура | Тригональный, 30 грн., космическая группа = R3с, № 167 |
| Постоянная решетки | а = 478,5 вечера, |
| Координационная геометрия | восьмигранный |
| Термохимия | |
| Стандартный моляр энтропия (S о298) | 50,92 Дж · моль−1· K−1[5] |
| Станд. Энтальпия формирование (ΔжЧАС ⦵298) | −1675,7 кДж / моль[5] |
| Фармакология | |
| Код УВД | D10AX04 (КТО) |
| Опасности | |
| Паспорт безопасности | Увидеть: страница данных |
| Пиктограммы GHS | |
| NFPA 704 (огненный алмаз) | 0 0 0 |
| точка возгорания | Не воспламеняется |
| NIOSH (Пределы воздействия на здоровье в США): | |
| PEL (Допустимо) | OSHA 15 мг / м3 (Всего пыли) OSHA 5 мг / м3 (Вдыхаемая фракция) ACGIH / TLV 10 мг / м3 |
| REL (Рекомендуемые) | никто[6] |
| IDLH (Непосредственная опасность) | N.D.[6] |
| Родственные соединения | |
| Другой анионы | гидроксид алюминия сульфид алюминия селенид алюминия |
| Другой катионы | триоксид бора оксид галлия оксид индия оксид таллия |
| Страница дополнительных данных | |
| Структура и характеристики | Показатель преломления (п ), Диэлектрическая постоянная (εр), так далее. |
| Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ |
| Спектральные данные | , , ЯМР, |
| Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Y проверить (что YN ?) | |
| Ссылки на инфобоксы | |
Оксид алюминия
это химическое соединение из алюминий и кислород с химическая формула 23. Это наиболее часто встречающийся из нескольких оксиды алюминия, и конкретно обозначено как
оксид алюминия (III)
. Это обычно называют
глинозем
а также может называться
алоксид
,
алоксит
, или
алунд
в зависимости от конкретных форм или приложений. Это происходит естественным образом в кристаллической форме. полиморфный фаза α-Al2О3 как минеральная корунд, разновидности которых составляют драгоценные драгоценные камни Рубин и сапфир. Al2О3 имеет важное значение в его использовании для производства металлического алюминия, как абразивный благодаря твердость, и как огнеупорный материал из-за его высокой температуры плавления.[7]
Содержание
- 1 Естественное явление
- 2 Свойства 2.1 Амфотерный характер
- 5.1 Наполнители
Оксидная плёнка[ | ]
Алюминий, являясь химически активным металлом, моментально образует при соприкосновении с кислородом воздуха на поверхности изделий из него тончайшую защитную оксидную плёнку Al2O3.
Защита от окисления и коррозии
| Этот раздел статьи ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться специальный раздел. Вы можете помочь проекту, написав этот раздел. Эта отметка установлена 29 января 2022 года . |
В электротехнике
| Этот раздел статьи ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться специальный раздел. Вы можете помочь проекту, написав этот раздел. Эта отметка установлена 29 января 2022 года . |
Свойства
Оксид алюминия в порошкообразном виде.
Al2О3 является электрический изолятор но имеет относительно высокий теплопроводность (30 Вт−1K−1)[2] для керамического материала. Оксид алюминия не растворяется в воде. В наиболее часто встречающейся кристаллической форме, называемой корунд или α-оксид алюминия, его твердость делает его пригодным для использования в качестве абразивный и как компонент в режущие инструменты.[7]
Оксид алюминия отвечает за устойчивость металлического алюминия к выветривание. Металлический алюминий очень реактивен с кислородом воздуха, а тонкий слой пассивации оксида алюминия (толщиной 4 нм) образуется на любой открытой поверхности алюминия за сотни пикосекунд.[нужен лучший источник
][11] Этот слой защищает металл от дальнейшего окисления. Толщина и свойства этого оксидного слоя могут быть улучшены с помощью процесса, называемого анодирование. Номер сплавы, такие как алюминиевые бронзы, используйте это свойство, включив в сплав часть алюминия для повышения коррозионной стойкости. Оксид алюминия, образующийся при анодировании, обычно аморфный, но процессы окисления при помощи разряда, такие как плазменное электролитическое окисление приводят к образованию значительной доли кристаллического оксида алюминия в покрытии, улучшая его твердость.
Оксид алюминия был снят с Агентство по охране окружающей среды СШАсписки химикатов в 1988 году. Оксид алюминия включен в EPA. Инвентаризация выбросов токсичных веществ перечислите, если это волокнистая форма.[12]
Амфотерный характер
Оксид алюминия — это амфотерный вещество, то есть может реагировать как с кислоты и базы, такие как плавиковая кислота и едкий натр, действуя как кислота с основанием и основание с кислотой, нейтрализуя другую и образуя соль.
Al2О3 + 6 ВЧ → 2 AlF3 + 3 часа2О Al2О3 + 2 NaOH + 3 Н2O → 2 NaAl (ОН)4 (алюминат натрия)
Удаление с алюминиевой посуды
Посуда, сделанная из алюминия, подвержена образованию накипи. Это обстоятельство напрямую связано с составом воды из водопровода. Чем больше в ней солей металлов, тем активнее будет образовываться накипь. Для обработки можно использовать те средства, которые есть под рукой.
Лимонная кислота
Для обработки от накипи готовится раствор лимонной кислоты. На каждые 1,5 литра нужно всыпать 25 грамм кислоты. Емкость доводят до кипения и оставляют для остывания. После этого можно промыть внутреннюю часть.
Уксус
Для обработки понадобится столовый уксус. Его разводят пополам с водой или используют неразведенным. Раствор заливают в емкость так, чтобы покрыть участки с накипью.
После доведения до кипения, алюминиевую посуду снимают с огня и дают остыть. Жидкость сливают, а саму посуду моют и кипятят уже с чистой водой.
Если на посуде остался запах уксуса, то можно его устранить простым способом: положить в емкость апельсиновую кожуру и залить ее водой. Через четверть часа емкость можно помыть и использовать по прямому назначению.
Структура
Корунд из Бразилия, размером примерно 2 × 3 см.
Наиболее распространенная форма кристаллического оксида алюминия известна как корунд, которая является термодинамически устойчивой формой.[13] Ионы кислорода образуют почти шестиугольный плотно упакованный структура с ионами алюминия, заполняющими две трети октаэдрических пустот. Каждый Al3+ центр восьмигранный. Что касается его кристаллография, корунд принимает тригональный Решетка Браве с космическая группа из р3c (номер 167 в международных таблицах). В примитивная клетка содержит две формульные единицы оксида алюминия.
Оксид алюминия также существует в других, метастабильных фазах, включая кубические γ- и η-фазы, моноклинную θ-фазу, гексагональную χ-фазу, орторомбическую κ-фазу и δ-фазу, которая может быть тетрагональной или орторомбической.[13][14] Каждый из них имеет уникальную кристаллическую структуру и свойства. Кубический γ-Al2О3 имеет важные технические приложения. Так называемый β-Al2О3 оказался NaAl11О17.[15]
Расплав оксида алюминия вблизи температуры плавления составляет примерно 2/3 четырехгранный (т.е. 2/3 Al окружены 4 кислородными соседями) и 1/3 5-координированы, с очень небольшим (восьмигранный Аль-О присутствует.[16] Около 80% атомов кислорода являются общими для трех или более полиэдров Al-O, и большинство межполиэдрических связей имеют общие углы, а остальные 10–20% имеют общие ребра.[16] Разрушение октаэдров при плавлении сопровождается относительно большим увеличением объема (~ 20%), плотность жидкости вблизи точки ее плавления составляет 2,93 г / см3.3.[17] Структура расплавленного оксида алюминия зависит от температуры, и доля алюминия в 5 и 6 раз увеличивается при охлаждении (и переохлаждении) за счет тетраэдрического AlO.4 единиц, приближающихся к местным структурным схемам, обнаруженным в аморфном оксиде алюминия.[18]
Характеристики алюминия
- Плотность алюминия — 2,7*103 кг/м3;
- Удельный вес алюминия — 2,7 г/cм3;
- Удельная теплоемкость алюминия при 20oC — 0,21 кал/град;
- Температура плавления алюминия — 658,7oC ;
- Удельная теплоемкость плавления алюминия — 76,8 кал/град;
- Температура кипения алюминия — 2000oC ;
- Относительное изменение объема при плавлении (дельтаV/V) — 6,6%;
- Коэффициент линейного расширения алюминия (при температуре около 20oC) : — 22,9 *106(1/град);
- Коэффициент теплопроводности алюминия — 180ккал/м*час*град;
Модули упругости алюминия и коэффициент Пуассона
| Наименование материала | Модуль Юнга, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
| Алюминиевая бронза, литье | 10500 | 4200 | — |
| Алюминиевая проволока тянутая | 7000 | — | — |
| Алюминий катаный | 6900 | 2600-2700 | 0,32-0,36 |
Отражение света алюминием
Числа, приведенные в таблице, показывают, какая доля света в %, падающего перпендикулярно к поверхности, отражается от нее.
| Наименование волн | Длина волны | Отражение света, % |
| Ультрафиолетовые | 1880 | 25 |
| 2000 | 31 | |
| 2510 | 53 | |
| 3050 | 64 | |
| 3570 | 70 | |
| Видимые | 5000 | — |
| 6000 | — | |
| 7000 | — | |
| Инфакрасные | 8000 | — |
| 10000 | 74 | |
| 50000 | 94 | |
| 100000 | 97 |
Производство
Алюминий гидроксид минералы являются основным компонентом боксит, главный руда из алюминий. Смесь минералов включает бокситовые руды, в том числе гиббсит (Al (OH)3), бемит (γ-AlO (OH)) и диаспора (α-AlO (OH)) вместе с примесями оксиды железа и гидроксиды, кварц и глинистые минералы.[19] Бокситы встречаются в латериты. Боксит очищается Процесс Байера:
Al2О3 + H2О + NaOH → NaAl (ОН)4 Al (ОН)3 + NaOH → NaAl (ОН)4
За исключением SiO2, остальные компоненты боксита в основе не растворяются. После фильтрации основной смеси Fe2О3 удален. Когда щелок Байера охлаждается, Al (OH)3 выпадает в осадок, оставляя силикаты в растворе.
NaAl (ОН)4 → NaOH + Al (ОН)3
Твердый Al (OH)3Гиббсит затем кальцинированный (нагретый до температуры более 1100 ° C) с образованием оксида алюминия:[7]
2 Al (OH)3 → Al2О3 + 3 часа2О
Получаемый оксид алюминия имеет тенденцию быть многофазным, то есть состоять из нескольких фаз оксида алюминия, а не только корунд.[14] Таким образом, производственный процесс можно оптимизировать для получения индивидуального продукта. Тип присутствующих фаз влияет, например, на растворимость и структуру пор продукта оксида алюминия, что, в свою очередь, влияет на стоимость производства алюминия и борьбу с загрязнением.[14]
Кратко о процессе
Плавка алюминия в домашних условиях — это не такой уж трудный процесс, которым он может показаться поначалу. Кусочки металла нагреваются до нужной температуры плавки алюминия в специальной емкости.
Некоторое время полученный расплав необходимо выдерживать в разогретом состоянии и периодически удалять с его поверхности образующийся шлак. После этого чистый жидкий металл наливается в специальную форму, в которой он некоторое время будет остывать.
Время, которое уйдет на плавку, зависит от самой печи, а точнее от той температуры, которую она может обеспечить. Если же вместо печи используется газовая горелка, то она должна нагревать металл сверху.
Приложения
| Эта секция нужны дополнительные цитаты для проверка . Пожалуйста помоги улучшить эту статью от добавление цитат в надежные источники. Материал, не полученный от источника, может быть оспорен и удален. |
Известен как альфа оксид алюминия в материаловедение сообщества или алунд (в плавленой форме) или алоксит[20] в добыча полезных ископаемых и керамика Сообщества оксид алюминия находит широкое применение. Годовое мировое производство оксида алюминия в 2015 году составило примерно 115 млн. тонны, более 90% которого используется в производстве металлического алюминия.[7] Основные области применения специальных оксидов алюминия — это огнеупоры, керамика, полировка и абразивные материалы. Большие объемы гидроксида алюминия, из которого получают глинозем, используются при производстве цеолиты, покрытие титания пигменты, а также как антипирен / подавитель дыма.
Более 90% производимого оксида алюминия, обычно называемого глиноземом плавильного производства (SGA), расходуется на производство алюминия, обычно Процесс Холла-Эру. Остальная часть, обычно называемая специальным оксидом алюминия, используется в самых разных областях, что отражает его инертность, термостойкость и электрическое сопротивление.[21]
Наполнители
Оксид алюминия, будучи довольно химически инертным и белым, является предпочтительным наполнителем для пластмасс. Оксид алюминия является обычным ингредиентом солнцезащитный крем а иногда также присутствует в косметических средствах, таких как румяна, помада и лак для ногтей.
Стекло
Многие составы стекло имеют оксид алюминия в качестве ингредиента.[22] Алюмосиликатное стекло — это широко используемый тип стекла, который часто содержит от 5% до 10% глинозема.
Катализ
Оксид алюминия катализирует множество реакций, которые используются в промышленности. В своем самом крупномасштабном применении оксид алюминия является катализатором в Процесс Клауса для преобразования отходящих газов сероводорода в элементарную серу на нефтеперерабатывающих заводах. Это также полезно при обезвоживании спирты в алкены.
Оксид алюминия служит носитель катализатора для многих промышленных катализаторов, например, используемых в гидрообессеривание и немного Циглер – Натта полимеризации.
Очистка газа
Оксид алюминия широко используется для удаления воды из газовых потоков.[23]
Абразивный
Оксид алюминия используется из-за его твердости и прочности. Его встречающаяся в природе форма, Корунд, это 9 на Шкала твердости минералов Мооса (чуть ниже ромба). Он широко используется как абразивный, в том числе как гораздо менее дорогой заменитель промышленный алмаз. Многие виды наждачная бумага использовать кристаллы оксида алюминия. Кроме того, его низкое удержание тепла и низкий удельная теплоемкость сделать его широко используемым в шлифовальных операциях, особенно отрезать инструменты. Как порошкообразный абразивный минерал алоксит, это основной компонент, наряду с кремнезем, из подсказка «мел» используется в бильярд. Порошок оксида алюминия используется в некоторых компакт диск/DVD полировка и наборы для ремонта царапин. Его полирующие качества также лежат в основе его использования в зубной пасте. Он также используется в микродермабразия, как в машинном процессе, доступном у дерматологов и косметологов, так и в виде ручного кожного абразива, используемого в соответствии с инструкциями производителя.
Покрасить
Основная статья: Пигмент с эффектом оксида алюминия
Чешуйки оксида алюминия используются в красках для создания отражающих декоративных эффектов, например, в автомобильной или косметической промышленности.[нужна цитата
]
Композитное волокно
Оксид алюминия использовался в нескольких экспериментальных и коммерческих волоконных материалах для высокопроизводительных приложений (например, Fiber FP, Nextel 610, Nextel 720).[24] Глинозем нановолокна в частности, стали областью научных исследований.
Бронежилет
В некоторых доспехах используются керамические пластины из оксида алюминия, обычно в сочетании с основой из арамида или СВМПЭ, чтобы обеспечить эффективность против большинства угроз от оружия. Керамическая броня из глинозема доступна для большинства гражданских лиц в юрисдикциях, где это разрешено законом, но не считается военным.[25]
Защита от истирания
Оксид алюминия можно выращивать в качестве покрытия на алюминии путем анодирование или по плазменное электролитическое окисление (см. «Свойства» выше). Оба твердость и характеристики устойчивости к истиранию покрытия обусловлены высокой прочностью оксида алюминия, однако пористый слой покрытия, полученный с помощью обычных процедур анодирования постоянным током, находится в диапазоне твердости 60-70 ° C по шкале Роквелла. [26] который сравним только с закаленными сплавами углеродистой стали, но значительно уступает по твердости природному и синтетическому корунду. Вместо этого с плазменное электролитическое окислениепокрытие является пористым только на поверхностном оксидном слое, в то время как нижние оксидные слои намного более компактны, чем при стандартных процедурах анодирования постоянным током, и имеют более высокую степень кристалличности из-за того, что оксидные слои переплавляются и уплотняются для получения кластеров α-Al2O3 с гораздо более высоким покрытием. значения твердости около 2000 твердости по Виккерсу.[нужна цитата
]
Производство оксида алюминия в 2005 г.
Глинозем используется для производства плиток, которые крепятся внутри линий пылевидного топлива и дымоходов на угольных электростанциях для защиты участков с высоким износом. Они не подходят для участков с высокими ударными нагрузками, поскольку эти плитки хрупкие и подвержены поломке.
Электрическая изоляция
Оксид алюминия является электрическим изолятор используется как подложка (кремний на сапфире) для интегральные схемы но также как туннельный барьер для изготовления сверхпроводящий такие устройства как одноэлектронные транзисторы и сверхпроводящие квантовые интерференционные устройства (Кальмары).
Для его применения в качестве электрического изолятора в интегральных схемах, где конформный рост тонкой пленки является предварительным условием и предпочтительным режимом роста является осаждение атомного слоя, Al2О3 пленки могут быть получены путем химического обмена между триметилалюминий (Al (CH3)3) и H2О:[27]
2 Al (CH3)3 + 3 часа2O → Al2О3 + 6 кан.4
ЧАС2O в указанной выше реакции можно заменить на озон (O3) в качестве активного окислителя, и тогда происходит следующая реакция:[28][29]
2 Al (CH3)3 + O3 → Al2О3 + 3 С2ЧАС6
Аль2О3 фильмы, подготовленные с использованием O3 показывают в 10–100 раз меньшую плотность тока утечки по сравнению с токами, полученными H2О.
Оксид алюминия, будучи диэлектриком с относительно большими запрещенная зона, используется как изолирующий барьер в конденсаторы.[30]
Другой
В освещении используется прозрачный оксид алюминия в некоторых натриевые лампы.[31] Оксид алюминия также используется для приготовления суспензий для покрытий в компактные люминесцентные лампы.
В химических лабораториях оксид алюминия является средой для хроматография, доступно в основной (pH 9,5), кислый (pH 4,5 в воде) и нейтральные составы.
Приложения для здравоохранения и медицины включают его в качестве материала в замена бедра[7] и противозачаточные таблетки.[32]
Он используется как сцинтиллятор [33] и дозиметр для радиационной защиты и терапии для его оптически стимулированная люминесценция свойства.[нужна цитата
]
Изоляцию высокотемпературных печей часто изготавливают из оксида алюминия. Иногда изоляция содержит различное процентное содержание кремнезема в зависимости от температурного режима материала. Изоляция может изготавливаться в виде одеяла, плиты, кирпича и волокнистого материала для различных требований.
Небольшие кусочки оксида алюминия часто используются в качестве кипячение чипсов по химии.
Он также используется для изготовления свеча зажигания изоляторы.[34]
Используя плазменный спрей процесс и смешанный с титания, он нанесен на тормозную поверхность некоторых велосипед обода для обеспечения устойчивости к истиранию и износу.[нужна цитата
]
Большинство керамических глазков на удилищах представляют собой круглые кольца из оксида алюминия.[нужна цитата
]
В тончайшем порошкообразном (белом) виде, называемом Диамантин, оксид алюминия используется как превосходный абразив для полировки в часовом и часовом деле.[35]
Убрать коррозию и окись
Очистить алюминиевые предметы — флягу, посуду, монеты – достаточно просто, если знать методы, которыми сделать это проще всего. При этом рекомендуется использовать не стандартные средства для мытья посуды, которые не справятся с сильными загрязнениями, а народные методы.
Винный камень
Почистить алюминий от черноты можно при помощи винного камня. Очистка алюминия от окиси и коррозии этим средством достаточно просто: требуется налить в посуду горячую воду, растворить в ней камень и добавить небольшое количество лимонной кислоты. Требуется довести полученный раствор до кипения, дать остыть и протереть при помощи мягкой ткани все стенки.
Винный камень можно развести водой так, чтобы получилась кашица, которой натирают посуду наподобие чистящего порошка. Это поможет вернуть материалу блеск.
Столовый уксус
При помощи 9%-ого столового уксуса запросто может производиться чистка алюминия. Обычно метод используется для монет, но на самом деле очистит не только их. Если речь идет о посуде, то просто требуется налить раствор в нее и довести до кипения. Потом позволить остыть и помыть предмет. Если требуется очистить другие вещи, то их следует прокипятить в этом растворе, а затем помыть.
использованная литература
- «Оксид алюминия_msds».
- ^ аб
Данные о свойствах материала: оксид алюминия (оксид алюминия) В архиве 2010-04-01 на Wayback Machine. Makeitfrom.com. Проверено 17 апреля 2013. - Патнаик, П. (2002). Справочник неорганических химикатов
. Макгроу-Хилл. ISBN 978-0-07-049439-8 . - Раймонд С. Роу; Пол Дж. Шески; Мэриан Э. Куинн (2009). «Адипиновая кислота». Справочник фармацевтических вспомогательных веществ
. Фармацевтическая пресса. С. 11–12. ISBN 978-0-85369-792-3 . - ^ аб
Зумдал, Стивен С. (2009).
Химические принципы 6-е изд.
. Компания Houghton Mifflin. ISBN 978-0-618-94690-7 . - ^ аб
Карманный справочник NIOSH по химической опасности. «#0021». Национальный институт охраны труда и здоровья (NIOSH). - ^ абcdе
«Глинозем (оксид алюминия) — различные типы коммерчески доступных марок». Материалы от А до Я. 3 мая 2002 г. Архивировано с оригинал 10 октября 2007 г.. Получено 27 октября 2007. - Элам, Дж. У. (октябрь 2010 г.). Приложения для осаждения атомных слоев 6
. Электрохимическое общество. ISBN 9781566778213 . - https://www.mindat.org/min-47933.html
- https://www.ima-mineralogy.org/Minlist.htm
- Кэмпбелл, Тимоти; Калия, Раджив; Накано, Айитиро; Вашишта, Прия; Огата, Сюдзи; Роджерс, Стивен (1999). «Динамика окисления нанокластеров алюминия с использованием молекулярно-динамического моделирования с переменным зарядом на параллельных компьютерах» (PDF). Письма с физическими проверками
.
82
(24): 4866. Bibcode:1999ПхРвЛ..82.4866С. Дои:10.1103 / PhysRevLett.82.4866. В архиве (PDF) из оригинала от 01.07.2010. - «Список химикатов EPCRA, раздел 313, за отчетный 2006 год» (PDF). Агентство по охране окружающей среды США. Архивировано из оригинал (PDF) на 2008-05-22. Получено 2008-09-30.
- ^ аб
И. Левин; Д. Брэндон (1998). «Метастабильные полиморфы оксида алюминия: кристаллические структуры и переходные последовательности».
Журнал Американского керамического общества
.
81
(8): 1995–2012. Дои:10.1111 / j.1151-2916.1998.tb02581.x. - ^ абc
Палья, Г. (2004). «Определение структуры γ-оксида алюминия с использованием эмпирических расчетов и расчетов из первых принципов в сочетании с подтверждающими экспериментами» (бесплатная загрузка). Кертинский технологический университет, Перт. Получено 2009-05-05. - Wiberg, E .; Холлеман, А. Ф. (2001). Неорганическая химия
. Эльзевир. ISBN 978-0-12-352651-9 . - ^ аб
Скиннер, L.B .; и другие. (2013). «Совместный дифракционно-модельный подход к структуре жидкого оксида алюминия».
Phys. Ред. B
.
87
(2): 024201. Bibcode:2013PhRvB..87b4201S. Дои:10.1103 / PhysRevB.87.024201. - Paradis, P.-F .; и другие. (2004). «Бесконтактные измерения теплофизических свойств жидкого и недостаточно охлажденного оксида алюминия». Jpn. J. Appl. Phys
.
43
(4): 1496–1500. Bibcode:2004JaJAP..43.1496P. Дои:10.1143 / JJAP.43.1496. - Ши, C; Олдермен, О. Л. Г.; Берман, Д; Du, J; Neuefeind, J; Тамалонис, А; Вебер, Р.; Вы, J; Бенмор, К. Дж. (2019). «Структура аморфного и глубоко переохлажденного жидкого оксида алюминия». Границы в материалах
.
6
(38): 38. Bibcode:2019FrMat … 6 … 38S. Дои:10.3389 / фматс.2019.00038. - «Статистика и информация по бокситам и глиноземам». USGS. В архиве из оригинала от 6 мая 2009 г.. Получено 2009-05-05.
- «Алоксит». База данных ChemIndustry.com. В архиве из оригинала 25 июня 2007 г.. Получено 24 февраля 2007.
- Эванс, К. А. (1993). «Свойства и применение оксидов алюминия и гидроксидов алюминия». В Даунсе, А. Дж. (Ред.). Химия алюминия, индия и галлия
. Блэки Академик. ISBN 978-0751401035 . - Акерс, Майкл Дж. (19 апреля 2016 г.). Стерильные лекарственные препараты: состав, упаковка, производство и качество
. CRC Press. ISBN 9781420020564 . - Хадсон, Л. Кейт; Мишра, Чанакья; Перротта, Энтони Дж .; Wefers, Karl and Williams, F. S. (2002) «Оксид алюминия» в Энциклопедия промышленной химии Ульмана
, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a01_557. - Маллик, П. (2008). Армированные волокном композитные материалы, производство и дизайн
(3-е изд., [Расширенное и исправленное] изд.). Бока-Ратон, Флорида: CRC Press. С. Гл.2.1.7. ISBN 978-0-8493-4205-9 . - «Баллистическая стойкость бронежилета» (PDF). Министерство юстиции США
. NIJ. Получено 31 августа 2022. - Осборн, Джозеф Х. (2014). «понимание и уточнение анодирования: что нужно знать производителю». OMW Corporation
. Архивировано из оригинал на 2016-11-20. Получено 2018-06-02. - Хигаси Г.С., Флеминг (1989). «Последовательная химическая реакция на поверхности ограничивает рост высококачественного Al2О3 диэлектрики ». Appl. Phys. Латыш
.
55
(19): 1963–65. Bibcode:1989АпФЛ..55.1963Х. Дои:10.1063/1.102337. - Kim JB; Kwon DR; Чакрабарти К; Ли Чонгму; О, KY; Ли Дж. Х. (2002). «Улучшение Al2О3 диэлектрические свойства при использовании озона в качестве окислителя для метода осаждения атомных слоев «. J. Appl. Phys
.
92
(11): 6739–42. Bibcode:2002JAP …. 92.6739K. Дои:10.1063/1.1515951. - Ким, Джебом; Чакрабарти, Кунтал; Ли, Джинхо; О, Ки-Ён; Ли, Чонгму (2003). «Влияние озона как источника кислорода на свойства Al2О3 тонкие пленки, полученные методом атомно-слоистого осаждения ». Mater Chem Phys
.
78
(3): 733–38. Дои:10.1016 / S0254-0584 (02) 00375-9. - Белкин, А .; Безрядин, А .; Hendren, L .; Хублер, А. (20 апреля 2017 г.). «Восстановление наноконденсаторов из оксида алюминия после высоковольтного пробоя». Научные отчеты
.
7
(1): 932. Bibcode:2017НатСР … 7..932Б. Дои:10.1038 / s41598-017-01007-9. ЧВК 5430567. PMID 28428625. - «Хронология инноваций GE 1957–1970». В архиве из оригинала 16 февраля 2009 г.. Получено 2009-01-12.
- «DailyMed — JUNEL FE 1/20 — ацетат норэтиндрона и этинилэстрадиол, а также фумарат железа». dailymed.nlm.nih.gov
. В архиве из оригинала от 13.03.2017. Получено 2017-03-13. - В. Михайлик, Х. Краус (2005). «Низкотемпературные спектроскопические и сцинтилляционные характеристики легированного Ti Al2О3″. Nucl. Instr. Phys. Res. А
.
546
(3): 523–534. Bibcode:2005NIMPA.546..523M. Дои:10.1016 / j.nima.2005.02.033. - Фарндон, Джон (2001). Алюминий
. Маршалл Кавендиш. п.. ISBN 9780761409472 . Оксид алюминия также используется для изготовления изоляторов свечей зажигания. - де Карл, Дональд (1969). Практический ремонт часов
. N.A.G. ООО «Пресс» с. 164. ISBN 0719800307 .