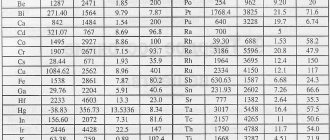
Кристаллическая решётка железа:
| 402 | Температура плавления* | 1538 °C (1811 K, 2800 °F) |
| 403 | Температура кипения* | 2861 °C (3134 K, 5182 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,81 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 340 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,448 Дж/г·K (при 25 °C), 0,64 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость* | 25,10 Дж/(K·моль) |
| 411 | Молярный объём | 7,1 см³/моль |
| 412 | Теплопроводность | 80,4 Вт/(м·К) (при стандартных условиях), 80,4 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 11,8 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,01 мм.рт.ст. (при 1425 °C), 0,1 мм.рт.ст. (при 1586 °C), 1 мм.рт.ст. (при 1790 °C), 10 мм.рт.ст. (при 2045 °C), 100 мм.рт.ст. (при 2376 °C) |
| 420 | Давление паров (Па) | 1 Па (при 1728 K), 100 кПа (при 3132 K) |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 27,15 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) |
| 424 | Стандартная мольная теплоемкость Cp | 25 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | Ферромагнитный материал (ниже 769 °C), парамагнитный материал (выше 769 °C) |
| 428 | Точка Кюри* | 769 °C (1042,15 К, 1416,2 °F) |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | Проводник |
| 433 | Электропроводность в твердой фазе | 10,0·10 6 См/м |
| 434 | Удельное электрическое сопротивление | 96,1 нОм·м (при 20 °C) |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | 4,0 |
| 440 | Твёрдость по Бринеллю | 200-1180 МПа |
| 441 | Твёрдость по Виккерсу | 608 МПа |
| 442 | Скорость звука | 5120 м/с (при 20 °C) (тонкий стержень) |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | 211 ГПа |
| 450 | Модуль сдвига | 82 ГПа |
| 451 | Объемный модуль упругости | 170 ГПа |
| 452 | Коэффициент Пуассона | 0,29 |
| 453 | Коэффициент преломления |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-железо (феррит) |
| 512 | Структура решётки | Кубическая объёмно-центрированная |
Физические свойства железа:
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга* | — α-железо (феррит) существует при температуре ниже 769 °C и нормальных условиях (точка Кюри железа 769 °C), — β-железо существует в интервале температур от 769 °C до 917 °C и нормальных условиях, — γ-железо (аустенит) существует в интервале температур от 917 °C до 1394 °C и нормальных условиях, — δ-железо существует при температуре выше 1394 °C и нормальных условиях, |
СТРУКТУРА
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86). В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла. В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей. При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
ПРОИСХОЖДЕНИЕ
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами. Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Источник
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой. Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д. Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным. При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Решетки ГЦК, ОЦК, ГПУ
Изучая кристаллическое строение металлов, охарактеризуем подробнее каждый тип кристаллической решетки. Начнем с ГЦК. Она показана ниже на рисунке.
Как видно, это решетка представляет собой кубик, в котором атомы расположены в его вершинах и в центрах всех шести граней. Применяя методы кристаллографии, несложно показать, что для получения такой решетки в пространстве достаточно всего четырех атомов и векторов трансляций, совпадающих с ребрами куба.
Примерами металлов, которые кристаллизуются в ГЦК, являются алюминий, медь, золото и серебро. Железо образует ГЦК решетку только при высоких температурах.
ОЦК решетка показана ниже.
Мы видим, что она соответствует кубику, в вершинах и в центре которого находится атом. Всего два атома необходимо, чтобы в прямоугольных декартовых координатах построить ОЦК решетку. Такие металлы, как ванадий, тантал, ниобий, вольфрам имеют именно эту кристаллическую структуру.
Наконец, ГПУ решетка. Она представлена ниже на рисунке.
Эта кристаллическая решетка металлов отличается от двух предыдущих тем, что она в пространстве образует не куб, а правильную шестиугольную призму, которая состоит из шести атомов. В данной структуре кристаллизуются такие элементы, как титан, цирконий, магний и кобальт.