Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Приложения
Производство ацетилена
Реакция карбида кальция с водой с образованием ацетилена и гидроксид кальция,[5] был обнаружен Фридрих Вёлер в 1862 г.
CaC2() + 2H2О(водный) → C2ЧАС2(грамм) + Са (ОН)2(водн.)
Эта реакция легла в основу промышленного производства ацетилен, и является основным промышленным применением карбида кальция.
Сегодня ацетилен в основном производится путем частичного сжигания метана или появляется как побочный продукт в потоке этилена при крекинге углеводородов. Таким образом ежегодно производится около 400 000 тонн (см. Приготовление ацетилена).
В Китае ацетилен, полученный из карбида кальция, остается сырьем для химическая индустрия, в частности для производства поливинил хлорид. Ацетилен местного производства более экономичен, чем использование импортного масла.[14] Производство карбида кальция в Китае увеличивается. В 2005 году добыча составила 8,94 миллиона тонн при мощности производства 17 миллионов тонн.[15]
В США, Европе и Японии потребление карбида кальция в целом снижается.[16] Уровень производства в США в 1990-е годы составлял 236 000 тонн в год.[13]
Производство цианамида кальция
Карбид кальция реагирует с азотом при высокой температуре с образованием цианамид кальция:[5]
CaC2 + N2 → CaCN2 + C
Обычно известный как нитролим, цианамид кальция используется в качестве удобрения. Гидролизуется до цианамид, H2NCN.[5]
Сталеплавильное производство
Карбид кальция используется:
- в обессеривание железа (чугун, чугун и сталь)[7]
- в качестве топлива в сталеплавильном производстве для увеличения доли брака в жидком чугуне в зависимости от экономических соображений.
- как мощный раскислитель в ковш очистные сооружения.
Карбидные лампы
Основная статья: Карбидная лампа
Горит карбидная лампа
Карбид кальция используется в карбидные лампы. При попадании капель воды на карбид образуется газ ацетилен, который горит и дает свет. Хотя эти лампы давали более ровный и яркий свет, чем свечи, они были опасны в каменный уголь шахты, где легковоспламеняющиеся метан газ сделал их серьезной опасностью. Наличие горючих газов на угольных шахтах привело к шахтерской лампы безопасности такой как Лампа Дэви, в котором проволочная сетка снижает риск воспламенения метана. Карбидные лампы по-прежнему широко использовались в шифер, медь, и банка шахты, где метан не представляет серьезной опасности. Большинство шахтерских ламп заменено на электрические. лампы.
Карбидные лампы все еще используются в горнодобывающей промышленности в некоторых менее богатых странах, например, в серебро шахты рядом Потоси, Боливия. Карбидные лампы все еще используются некоторыми спелеологи исследуя пещеры и другие подземные области,[17] хотя они все чаще заменяются в этом использовании ВЕЛ огни.
Карбидные лампы также широко использовались в качестве Фары в ранних автомобилях, мотоциклах и велосипедах, но были полностью заменены электрическими лампами.[18]
Другое использование
Карбид кальция иногда используется как источник газообразного ацетилена, который является агент созревания похожий на этилен.[19] Однако в некоторых странах это незаконно, поскольку при производстве ацетилена из карбида кальция загрязнение часто приводит к образованию следов фосфин и арсин.[20][21] Эти примеси можно удалить, пропустив ацетиленовый газ через подкисленный сульфат меди решение, но в развивающихся странах этой мерой предосторожности часто пренебрегают.
Карбид кальция используется в игрушечных пушках, таких как Пушка Большого Взрыва, а также в бамбуковые пушки. В Нидерландах карбид кальция используется ближе к новому году для стрельбы из маслобойки.[22]
Карбид кальция вместе с фосфид кальция, используется в плавучих самовоспламеняющихся морских сигнальные ракеты, например, производимые Ассоциация защиты морской жизни Холмса.
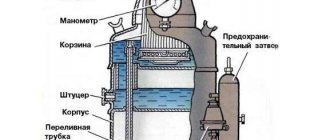
Карбид кальция используется для определения влажности почвы. Когда почва и карбид кальция смешиваются в закрытом цилиндре под давлением, вода, содержащаяся в почве, реагирует с карбидом кальция с выделением ацетилена, давление которого можно измерить для определения содержания влаги.[23][24]
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Можно ли тушить водой карбид кальция?
Calcium carbide является негорючим продуктом, но выделяющийся при его разложении ацетилен взрыво- и пожароопасен. Он легко воспламеняется даже при кратковременном контакте с воздухом и обладает способностью самовоспламеняться даже в чистом виде. Он также легко вступает в реакцию с солями меди, серебра и ртути с образованием нестойких взрывчатых ацетеленидов. Обладает наркотическим действием, обусловленным фосфористым водородом в его составе.
Реагент ни в коем случае не разрешается тушить водой! При попадании жидкости в емкости с веществом возможны взрывы. Для тушения следует применять сухие порошковые огнетушители, сухой песок, углекислоту, асбестовое полотно.
Ацетилен легче воздуха, поэтому возможно его накопление в высших точках слабовентилируемых помещений.
Источники
- https://pressadv.ru/metally-svarka/gde-vzyat-karbid.html
- https://stpoyka.ru/chto-takoe-karbid-opisanie-osobennosti-primenenie-i-cena-karbida/
- https://charchem.org/ru/subst-ref/?id=2004
- https://chem.ru/karbid-kalcija.html
- https://ru.warbletoncouncil.org/carburo-de-calcio-9133
- https://www.syl.ru/article/150446/mod_karbid-kaltsiya-svoystva-i-primenenie-poluchenie-atsetilena
- https://weldering.com/karbid-kalciya-acetilen-druzya-razley-voda
- https://him-kazan.ru/stati/karbid-kalcziya
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала. К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.
Техника безопасности
При проведении различных химических реакций для производства материалов должна соблюдаться техника безопасности. Как ранее было отмечено, выделяемые вещества могут быть взрывоопасными. Техника безопасности при взаимодействии с различными химическими веществами заключается в следующем:
- Для хранения и обработки требуется герметичное место. В обычном гараже проводить работы не рекомендуется.
- Нельзя допускать огонь к самому сырью, а также образующимся газам.
- Даже мелкие частицы могут привести к поражению кожных покровов. Именно поэтому работа должна проводится в респираторе и защитной одежде.
- Генераторы ацетилена размещают исключительно в хорошо изолированных помещениях.
- Если сырье применялось при проведении сварочных работ, то следует образующийся шлак утилизировать в специальных местах.
- При перемещении металлических и иных емкостей они должны быть надежно закреплены, столкновение и падение не допускается. Это может привести к появлению искр, которые станут причиной взрыва вещества.
Горение карбида кальция
Вышеприведенная информация определяет то, что работы с рассматриваемым сырьем не рекомендуется проводить в гараже или домашней мастерской. Несоблюдении технологии, отсутствии требующего оснащения и многие другие причины могут привести к возникновению искры и воспламенению веществ.