Бутан, получение, свойства, химические реакции.
Бутан, C4H10 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Образуется также при крекинге нефтепродуктов.
Бутан, формула, газ, характеристики
Физические свойства бутана
Химические свойства бутана
Получение бутана
Химические реакции – уравнения получения бутана
Применение и использование бутана
Бутан, формула, газ, характеристики:
Бутан – органическое вещество класса алканов, состоящий из четырех атомов углерода и десяти атомов водорода. Название происходит от корня «бут-» (французское название масляной кислоты – acide butyrique) и суффикса «-ан» (что означает принадлежность к алканам).
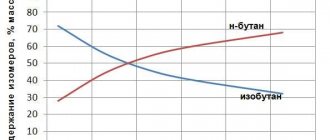
Химическая формула бутана C4H10. Имеет два изомера н-бутан и изобутан. В химии название «бутан» используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана.
Рациональная формула н-бутана CH3-CH2-CH2-CH3, изобутана CH(CH3)3.
Строение молекулы н-бутана:
Строение молекулы изобутана:
Бутан – бесцветный газ, без вкуса, со специфическим характерным запахом.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Малотоксичен, но оказывает вредное воздействие на человека – на нервную систему (отравление, рвота, возможен летальный исход), обладает наркотическими свойствами, может вызвать удушье и сердечную аритмию, вызывает дисфункцию лёгочно-дыхательного аппарата. Класс опасности четвертый.
Получение ароматических углеводородов (аренов)
Декарбоксилирование солей ароматических карбоновых кислот
Сплавлением солей ароматических карбоновых кислот со щелочами удается получить ароматические углеводороды с меньшим числом атомов углерода в молекуле по сравнению с исходной солью:
Тримеризация ацетилена
При пропускании ацетилена при температуре 400°C над активированным углем с хорошим выходом образуется бензол:
Аналогичным способом можно получать симметричные триалкилзамещенные бензолы из гомологов ацетилена. Например:
Дегидрирование гомологов циклогексана
При действии на циклоалканы с 6-ю атомами углерода в цикле высокой температуры в присутствии платины происходит дегидрирование с образованием соответствующего ароматического углеводорода:
Дегидроциклизация
Также возможно получение ароматических углеводородов из углеводородов нециклического строения при наличии углеродной цепи с длиной в 6 или более атомов углерода (дегидроциклизация). Процесс осуществляют при высоких температурах в присутствии платины или любого другого катализатора гидрирования-дегидрирования (Pd, Ni):
Физические свойства бутана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 601,2 |
| Плотность (состояние вещества – газ, при 0 °C), кг/м3 | 2,672 |
| Температура плавления н-бутана, °C | -138,4 |
| Температура плавления изобутана, °C | -159,6 |
| Температура кипения н-бутана, °C | -0,5 |
| Температура кипения изобутана, °C | -11,7 |
| Температура самовоспламенения, °C | 372 |
| Критическая температура*, °C | 152,01 |
| Критическое давление, МПа | 3,797 |
| Критический удельный объём, м3/кг | 228 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 1,4 до 9,3 |
| Удельная теплота сгорания, МДж/кг | 45,8 |
| Молярная масса, г/моль | 58,12 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства алканов
Алканы ввиду насыщенности связей при нормальных условиях являются инертными веществами (их еще называют «химические мертвецы»). Они не способны вступать в реакции восстановления, при комнатной температуре не окисляются даже под действием таких сильных окислителей как К2Cr2O7, KMnO4 и т.п. Однако в определенных условиях они могут вступать в реакции окисления (горения), дегидрирования, дегидроциклизации, изомеризации, разложения (крекинг), замещения.
1.Реакция дегидрирования (протекает при повышенной температуре в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO):
СН3-СН2-СН3 → СН3-СН=СН2 + H2 (катализатор — Ni, 500°С)
пропан пропен
СН3-СН2-СН2-СН3 → СН3-СН=СН-СН3 + H2 (катализатор — Ni, 500°С)
бутан бутен-2
СН3-СН2-СН2-СН3 → CH2=CH-CH=CH2 + H2 (катализатор — Cr2O3/Al2O3, ~550°С)
бутан бутадиен-1,3
2СН4 → CH≡CH+ H2 (катализатор — С, 1500°С)
метан ацетилен
2.Реакция дегидроциклизации (протекает при повышенной температуре в присутствии катализаторов):
3.Реакция изомеризации (протекает при повышенной температуре в присутствии катализатора):
4.Крекинг (нагрев до высоких температур без доступа воздуха):
C6H14 → C3H8 + C3H6
5.Окисление:
Неполное окисление алканов используют для получения карбоновых кислот, кетонов, альдегидов, спиртов:
СН3-СН2-СН2-СН3 + 3O2 → 2СН3-СOOH + 2H2O
бутан уксусная кислота
Действие кислорода воздуха в присутствии солей марганца на алканы с числом атомов углерода в цепи более 25 приводит к образованию смеси карбоновых кислот, среднее число атомов углерода в цепи которых составляет 12-18.
Полное окисление алканов (горение) –это экзотермическая реакция, которая сопровождается разрывом всех С-С и С-Н связей:
C6H14 + 9,5O2 6CО2 + 7H2O + Q
Низшие алканы (метан, этан, пропан, бутан) – легко воспламеняются, увеличение углеродной цепи алканов ведет к затруднению их горения, что объясняется недостатком кислорода воздуха, необходимого для полного окисления всего углерода. При этом происходит горение с образованием копоти, угарного газа.
6.Реакция образования «синтез-газа»:
СН4 + H2O → CO + 3H2 (катализатор — Ni, 800°С)
7. Реакция замещения (SR)
Замещение атома водорода происходит по радикальному механизму. Вначале преимущественно замещается третичный атом углерода, затем вторичный и первичный.
- Реакция галогенирования алканов возможна только при действии света или высокой температуры. При этом образуются галогеналканы:
Реакция продолжается до тех пор, пока не израсходуется один из реагентов. При большом количестве галогена в результате реакции образуется смесь продуктов замещения 2-х, 3-х и т.д. атомов водорода
- Реакция нитрования алканов (реакция Коновалова) протекает при действии разбавленной азотной кислоты:
- Реакция сульфохлорирования
CH3(CH2)10CH3 + SO2 + Cl2CH3(CH2)10CH2-SO2Cl + HCl CH3(CH2)10CH2-SO2Cl + 2NaOHCH3(CH2)10-CH2SO3Na + NaCl
Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
- 2. галогенирование бутана:
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
и т.д.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование бутана:
См. нитрование этана.
- 4. окисление (горение) бутана:
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование бутана:
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
- 6. сульфоокисление бутана:
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Химические свойства
Какими свойствами характеризуется изобутан? Общая формула класса — СпН2п+2, поэтому они не могут вступать в реакции присоединения. Изоалканы горят в кислороде воздуха, образуя углекислый газ, водяной пар, выделяя существенное количество тепловой энергии.
Для всех представителей данного класса органических углеводородов характерно радикальное замещение. Учитывая, что в молекуле изобутана есть более подвижный (центральный) углеродный атом, замещение протекает быстрее, чем у бутана нормального строения.
Среди всех представителей класса алканов особый интерес представляет именно изобутан. Он способен взаимодействовать с галогенами (бромом, хлором) под воздействием света с образованием галогензамещенного алкана. Данное свойство используется для получения вторичных одноатомных спиртов.
Изобутан востребован в качестве хладагентов. Долгое время считали, что именно это соединение оказывает негативное воздействие на озоновый слой атмосферы, разрушает его целостность. Но была установлена способность самопроизвольного восстановления толщины озонового слоя, что подтвердило безопасность хладагентов, в основе которых изобутан. Формула данного углеводорода знакома и в парфюмерной промышленности, и в медицине. Здесь он применяется для производства аэрозолей.
Высокое октановое число изобутана позволяет использовать данный углеводород для производства специального компонента, используемого в качестве добавки к бензину. Изобутан применяют в качестве индивидуального топлива, заправляя данным соединением газовые зажигалки.
Получение бутана. Химические реакции – уравнения получения бутана:
Так как бутан в достаточном количестве содержится в природном газе, попутном нефтяном газе и выделяется при крекинге нефтепродуктов, его не получают искусственно. Его выделяют при очистке и сепарации из природного газа, ПНГ и нефти при перегонке.
Бутан в лабораторных условиях получается в результате следующих химических реакций:
- 1. гидрирования непредельных углеводородов, например, бутена:
CH3-CH2-CH=CH2 + H2 → CH3-CH2-CH2-CH3 (kat = Ni, Pt или Pd, повышенная to).
- 2. восстановления галогеналканов:
C4H9I + HI → C4H10 + I2 (повышенная to);
C4H9Br + H2 → C4H10 + HBr.
- 3. взаимодействия галогеналканов с металлическим щелочным металлом, например, натрием (реакция Вюрца):
2C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr;
2C2H5Cl + 2Na → CH3-CH2-CH2-CH3 + 2NaCl.
Суть данной реакции в том, что две молекулы галогеналкана связываются в одну, реагируя с щелочным металлом.
- 4. щелочного плавления солей одноосновных органических кислот:
C4H9-COOH + NaOH → C4H10 + Na2CO3 (повышенная to);
C4H9-COONa + NaOH → C4H10 + NaHCO3.
Получение алканов
Крекинг алканов с изначально большей длиной цепи
Процесс, используемый в промышленности, протекает в интервале температур 450-500oC в присутствии катализатора и при температуре 500-700oC в отсутствие катализатора:
Важность промышленного процесса крекинга заключается в том, что он позволяет повысить выход бензина из тяжелых фракций нефти, которые не представляют существенной ценности сами по себе.
Гидрирование непредельных углеводородов
- алкенов:
- алкинов и алкадиенов:
Газификация каменного угля
в присутствии никелевого катализатора при повышенных температуре и давлении может быть использована для получения метана:
Процесс Фишера-Тропша
С помощью данного метода могут быть получены предельные углеводороды нормального строения, т.е. алканы. Синтез алканов осуществляют, используя синтез-газ (смеси угарного газа CO и водорода H2), который пропускают через катализаторы при высоких температуре и давлении:
Реакция Вюрца
С помощью данной реакции могут быть получены углеводороды с большим числом атомов углерода в цепи, чем в исходных углеводородах. Реакция протекает при действии на галогеналканы металлического натрия:
Декарбоксилирование солей карбоновых кислот
Сплавление твердых солей карбоновых кислот со щелочами приводит к реакции декарбоксилирования, при этом образуются углеводород с меньшим числом атомов углерода и карбонат металла (реакция Дюма):
Гидролиз карбида алюминия
Взаимодействие карбида алюминия с водой, а также кислотами-неокислителями приводит к образованию метана:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Получение алкенов
Крекинг алканов
Реакция в общем виде уже была рассмотрена выше (получение алканов). Пример реакции крекинга:
Дегидрогалогенирование галогеналканов
Дегидрогалогенирование галогеналканов протекает при действии на них спиртового раствора щелочи:
Дегидратация спиртов
Данный процесс протекает в присутствии концентрированной серной кислоты и нагревании до температуры более 140оС:
Обратите внимание, что и в случае дегидратации, и в случае дегидрогалогенирования отщепление низкомолекулярного продукта (воды или галогеноводорода) происходит по правилу Зайцева: водород отщепляется от менее гидрированного атома углерода.
Дегалогенирование вицинальных дигалогеналканов
Вицинальными дигалогеналканами называют такие производные углеводородов, у которых атомы хлора прикреплены к соседним атомам углеродной цепи.
Дегидрогалогенирование вицинальных галогеналканов можно осуществить, используя цинк или магний:
Дегидрирование алканов
Пропускание алканов над катализатором (Ni, Pt, Pd, Al2O3 или Cr2O3) при высокой температуре (400-600оС) приводит к образованию соответствующих алкенов:
Получение алкадиенов
Дегидрирование бутана и бутена-1
В настоящий момент основным методом производства бутадиена-1,3 (дивинила) является каталитическое дегидрирование бутана, а также бутена-1, содержащихся в газах вторичной переработки нефти. Процесс проводят в присутствии катализатора на основе оксида хрома (III) при 500—650°С:
Действием высоких температур в присутствии катализаторов на изопентан (2-метилбутан) получают промышленно важный продукт – изопрен (исходное вещество для получения так называемого «натурального» каучука):
Метод Лебедева
Ранее (в Советском Союзе) бутадиен-1,3 получали по методу Лебедева из этанола:
Дегидрогалогенирование дигалогензамещенных алканов
Осуществляется действием на галогенпроизводные спиртового раствора щелочи:
Получение алкинов
Получение ацетилена
Пиролиз метана
При нагревании до температуры 1200-1500оС метан подвергается реакции дегидрирования с одновременным удваиванием углеродной цепи – образуются ацетилен и водород:
Гидролиз карбидов щелочных и щелочноземельных металлов
Действием на карбиды щелочных и щелочно-земельных металлов воды или кислот-неокислителей в лаборатории получают ацетилен. Наиболее дешев и, как следствие, наиболее доступен для использования карбид кальция: