Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пентаноата натрия с гидроксидом натрия при сплавлении образуются бутан и карбонат натрия:
CH3–CH2–CH2– CH2 –COONa + NaOH → CH3–CH2– CH2 – CH3 + Na2CO3
Как из алкана получить алкан
В промышленности практически все виды предельных углеводородов получают из нефтегазового сырья. Переработка нефти — современный метод получения алканов из алканов:
А) Жидкие предельные углеводороды дает прямая перегонка нефти (низкий выход целевых продуктов).
Б) Термический и каталитический крекинги нефти применяют для увеличения процентного содержания легких фракций, улучшения качества получаемых углеводородов (бензина, керосина). В соляровой фракции нефти присутствует гексадекан, который при распаде дает додекан и бутилен. Додекан уже в составе керосиновой фракции подвергается дальнейшему распаду, из него получают предельный углеводород нонан и пропен (алкен). Продолжение крекинга может привести к образованию гептана и этилена.
Бутан плюс вода катализатор
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт «Отношение метана к раствору перманганата калия и бромной воде»
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400 о C.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
(hv — формула кванта света)
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:
Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт «Взаимодействие алканов с бромом при нагревании»
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 140 0 С и при повышенном или нормальном давлении — реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
Реакции окисления
Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Видеоопыт «Взрыв смеси метана с кислородом»
Видеоопыт «Горение жидких алканов»
Видеоопыт «Горение твердых углеводородов (на примере парафина)»
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Учебный фильм «Каталитическое окисление высших парафиновых углеводородов»
Термические превращения алканов (реакции разложения)
1. Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700 0 С:
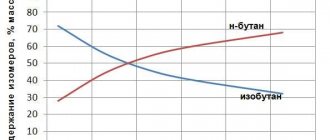
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 1000 0 С начинается пиролиз – разложение на простые вещества:
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом – «синтез-газ» (водяной газ, генераторный газ):
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Реакции отщепления
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А123, Сг23) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена:
2. Если метан нагреть до более высокой температуры (1500 0 С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
3.Дегидроциклизация (ароматизация) — реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 300 0 С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные):
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:
Как из алкана получить алкан
Никотин: смертельная доза, токсичность, состав, химические свойства
В промышленности практически все виды предельных углеводородов получают из нефтегазового сырья. Переработка нефти — современный метод получения алканов из алканов:
А) Жидкие предельные углеводороды дает прямая перегонка нефти (низкий выход целевых продуктов).
Б) Термический и каталитический крекинги нефти применяют для увеличения процентного содержания легких фракций, улучшения качества получаемых углеводородов (бензина, керосина). В соляровой фракции нефти присутствует гексадекан, который при распаде дает додекан и бутилен. Додекан уже в составе керосиновой фракции подвергается дальнейшему распаду, из него получают предельный углеводород нонан и пропен (алкен). Продолжение крекинга может привести к образованию гептана и этилена.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
| Например, алкан имеет название 2-метилпропан. |
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
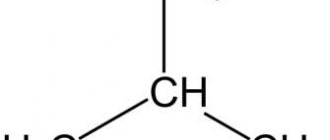
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
| а | б |
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
| а | б |
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
Как получить этиловый и другие спирты из алканов
В древности над вопросом: «Как из алкана получить спирт?» не размышляли, наши предки использовали только способ спиртового брожения сахаросодержащих продуктов под действием ферментов дрожжей. Рост технического значения этилового спирта привел к поиску новых видов непищевого сырья для получения этанола. В первой половине минувшего столетия вещество стало незаменимым сырьем для производства каучука по методу Лебедева. Один из методов был предсказан еще А. М. Бутлеровым, который мечтал, что дешевый способ получения этилена откроет путь «для добывания спирта». Источниками непредельных углеводородов служат продукты крекинга нефти и каталитическое дегидрирование алканов. Из этана получают этилен, который окисляется в присутствии серной кислоты: С2Н6 → С2Н4 → С2Н5ОН. Гидратация других алкенов, которые также получают при переработке нефти, дает гомологи синтетического этилового спирта. Недостатки способа выражаются в затратах на регенерацию кислоты и защиту аппаратов от ее коррозийного воздействия. Промышленность перешла на метод прямой гидратации алкенов, в котором применяются твердые катализаторы. Метанол получают при окислении метана. Этилен и его гомологи служат сырьем для производства спиртов.
Как из алкана получить ацетилен
Углеводород с одной тройной связью — ацетилен — очень важен в промышленной отрасли, строительстве и других областях хозяйственной деятельности. Старейший способ получения этого простейшего алкина связан с действием воды на твердые кусочки карбида кальция. На смену этому методу пришел крекинг природного газа. Теперь на предприятиях химической отрасли знают, как из алкана получить алкин с наименьшими затратами. В специальных технологических аппаратах при высокой температуре или под действием электрического разряда происходит дегидрирование метана — преобладающего вещества природного газа: 2СН4 → HC≡CH + 3Н2. Ацетилен находит широкое применение, из него получают ацетальдегид, который далее используется в производстве уксусной кислоты, искусственных смол, пластмасс, синтетических волокон, каучуков и резин.
Окисление этилового спирта до уксусной кислоты
Микробиология —
Превращение микроорганизмами соединений углерода
Этиловый спирт окисляется до уксусной кислоты под влиянием уксуснокислых бактерий, относящихся к родам Gluconobacter и Acetobacter. Это грамотрицательные хемоорганогетеротрофные, не образующие спор, палочковидные организмы, подвижные или неподвижные.
Два рода уксуснокислых бактерий различаются между собой по характеру жгутикования клеток. У представителей рода Gluconobacter клетки движутся при помощи 3—8 полярных жгутиков, редко одного, или неподвижные. Бактерии рода Acetobacter движутся при помощи перитрихиальных жгутиков или неподвижные.
Уксуснокислые бактерии — строгие аэробы, поэтому они развиваются только на поверхности среды, и для них весьма характерно образование пленок. Одни виды этих организмов образуют тонкие пленки, состоящие лишь из одного слоя клеток, другие формируют пленки более толстые, иногда напоминающие папиросную бумагу. Некоторые уксуснокислые бактерии дают пленки слизистые, толстые. Уксуснокислые бактерии отличаются высокой устойчивостью к кислотам (могут расти в среде с начальным pH 4, оптимум pH 5—6). Эти бактерии обнаруживают на поверхности растений (цветков, плодов), на разлагающихся растительных остатках и т. д.
Характерная особенность уксуснокислых бактерий – их способность превращать этиловый спирт в уксусную кислоту:
СН3СН2ОН + О2 -» СН3СООН + Н2О
Два рода уксуснокислых бактерий различаются по степени окисления органических субстратов. Так, уксуснокислые бактерии рода Acetobacter (A. peroxydans) накапливают уксусную кислоту в качестве промежуточного продукта и могут подвергать ее дальнейшему окислению до СО2 и Н2О (эти бактерии называют переокислителями), а бактерии рода Gluconobacter (G. oxydans) вызывают образование уксусной кислоты как конечного продукта реакции, который обычно не подвергается последующему окислению (эти бактерии называют иедоокислителями). Способность видов рода Acetobacter окислять уксусную кислоту до СО2 объясняется наличием у них цикла трикарбоновых кислот. Уксуснокислые бактерии способны окислять не только этиловый спирт, но и другие спирты, в том числе алифатические многоатомные.
Кроме указанных окислительных процессов, уксуснокислые бактерии могут вызывать окисление сорбита до сорбозы, маннита до фруктозы, глюкозы до глюконовой кислоты, глюконовой кислоты до кетоглюконовых кислот. Эти окислительные превращения осуществляются по пентозофосфатному пути представителями рода Gluconobacter. Особый интерес представляет окисление уксуснокислыми бактериями D — сорбита до L — сорбозы. Последняя требуется в больших количествах для синтеза витамина С.
Интересно отметить, что представитель рода Acetobacter — Acetobacter xylinum при росте на среде с глюкозой или другими источниками углерода способен образовывать внеклеточную слизистую пленку, состоящую из чистой целлюлозы. Целлюлозные фибриллы представляют собой рыхлую массу, окружающую клетки бактерий. В культуре эти организмы образуют пленку толщиной 1 см и более, состоящую из целлюлозы и бактериальных клеток.
Уксуснокислых бактерий используют для производства пищевого уксуса из вина и спирта.