Нахождение в природе
Сульфид меди(I) в природе встречается в виде минерала халькозина (устаревшие названия: халькоцит, редрутит, медный блеск). Также, по составу данному соединению близок минерал джюрлеит, иногда называют джарлеит (подробнее см. Сульфиды меди). Основные свойства представлены в таблице.
| Халькозин | Джюрлеит | |
| Состав | Cu2S | Cu1,94S |
| Цвет | темно-серый | чёрный |
| Сингония | ромбическая | моноклинная |
| Плотность, г/см³ | 5,5—5,8 | 5,5—5,7 |
| Твердость | 2,5—3,0 | 2,2—2,4 |
«Загадочная медь» (стр. 2 )
В избытке концентрированного раствора сильной щелочи гидроксид меди(II) растворим вследствие образования синих купритов (NaHCuO2 , NaCuO2 и т. п.). Однако последние весьма неустойчивы и при разбавлении раствора разлагаются с выделением Cu(OH)2 .
Применяется в качестве пигмента под названием «бремовой сини».
Хлорид меди (II) CuCl2.
2H2O
. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди (II) имеют зеленый цвет, разбавленные — сине-голубой, т. к. при этом происходит образование аквакомплексов [Cu(H2O)6]2+.
Растворяется в воде, аммиаке, пиридине, эфире, спирте. Известны кристаллогидраты CuCl2.
nН2О (n=1, 2, 3, 4). Получают действием хлора на медь, реакцией оксида или гидроксида меди(II) с хлороводородной кислотой.
Бромид меди (II) CuBr2
. Черные кристаллы. Растворяется в воде и спирте, пиридине, ацетоне. Известен кристаллогидрат CuBr2
.
2Н2О. Получают действием жидкого брома на медь, реакцией оксида или гидроксида меди (II) с бромоводородной кислотой.
Фторид меди (II) CuF2
. Белые мелкие кристаллы. Растворяется в аммиаке, фтороводородной, хлороводородной и азотной кислотах, пиридине, этилацетате. Восстанавливается до меди водородом. Разлагается парами воды. Получают нагреванием меди с фтором.
Нитрат меди(II) Cu(NO3)2.
В твердом виде представляет синие кристаллы Cu(NO3)2
.
H2O. При нагревании кристаллы нитрата меди(II) сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди(II). Получается при растворении меди в азотной кислоте.
Сульфат меди(II) CuSO4
В безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+ или [Cu(H2O)6]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди(II), если только они не содержат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Получают дегидратацией кристаллогидратов, обработкой меди концентрированной серной кислотой. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков. В природе встречается в виде минерала халькантита (CuSO4
.
5Н2О).
Гидроксокарбонат меди(II) (CuOH)2CO3
. Встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зеленый цвет. Искусственно получается действием Na2CO3 на растворы солей меди(II).
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3 + 2Na2SO4 + CO2↑
Применяется для получения хлорида меди(II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди(II) Cu(CH3COO)2.
H2O
. Получается обработкой гидроксида или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Большинство солей двухвалентной меди растворимы в воде, а растворы часто имеют кислую реакцию. Со слабыми кислотами медь образует основные соли.
Летучие соединения меди окрашивают несветящееся пламя газовой горелки в сине-зелёный цвет.
В разбавленных растворах цвет солей двухвалентной меди с бесцветными анионами сине-голубой (цвет иона Cu2+) . Напротив, окраска твердых солей различна. В частности, наиболее практически важная из них – медный купорос (CuSO4 .
5Н2О) – имеет синий цвет.
Комплексообразование для двухвалентной меди весьма характерно. Это видно уже из того, что почти все соли Cu2+ выделяются из растворов в виде кристаллогидратов. С соответствующими солями щелочных металлов соли Cu2+ дают двойные соединения, содержащие медь в составе комплексных анионов (например, [CuCl4]2-).Однако большинство последних неустойчиво и в растворе распадается на составные части. Значительно устойчивее очень характерный для двухвалентной меди темно-синий комплексный катион [Cu(NH3)4] 2+, образующийся при прибавлении избытка аммиака к растворам Cu2+ по реакции, например:
CuSO4 + 4NH 3.
H2О = [Cu(NH3)4]SO4 + 4H2O
В связи с интенсивной окраской этого комплекса, аммиаком можно пользоваться как реактивом на медь.
Для одновалентной меди также свойственны амминокоплексы [Cu(NH3)2]+. Поэтому соединения Сu(I) в присутствии аммиака могут растворяться:
CuClт + 2NH3.
H2Oж = [Cu(NH3)2]Clр
С помощью солей меди получают разноообразные по цвету минеральные краски: зелёные, синие, коричневые, фиолетовые и чёрные.
Все соли меди ядовиты. Например, смешанный ацетат-арсенит меди(II) — Cu(CH3COO)2•3Cu(AsO2)2 — применяется под названием «парижская зелень» для уничтожения вредителей растений.
В быту, чтобы избежать образования ядовитых медных солей, медную посуду покрывают изнутри слоем олова (лудят).
После анализа всей полученной информации, мы обнаружили, что наши представления о свойствах меди и ее соединений отличались от реальных. Эти различия приведены в таблице 1.
Таблица 1
| Медь или ее соединение | Свойства | |
| Наши представления | Новые знания | |
| Cu | С соляной, бромоводородной кислотами и раствором серной кислоты не взаимодействует | Взаимодействие возможно |
| Cu | С водой и растворами щелочей не взаимодействует. | Взаимодействует с водой в присутствии аммиака |
| Cu | С растворами солей более активных металлов не взаимодействует | Взаимодействует с растворами некоторых солей |
| Cu2O | С водой не взаимодействует | Растворяется в воде в присутствии аммиака |
| Cu2O | Основный оксид | Амфотерный оксид |
| CuO | С водой не взаимодействует | Растворяется в воде в присутствии аммиака |
| CuO | Основный оксид | Амфотерный оксид |
| Cu(OH)2 | Нерастворимое основание | Амфотерный гидроксид Растворяется в воде в присутствии аммиака |
Для проверки новой информации о меди и ее соединениях в экспериментальной части работы были выполнены следующие опыты:
· Растворение меди в растворе аммиака.
· Взаимодействие меди с концентрированной соляной и
разбавленной серной кислотами.
· Растворение меди в растворе хлорида железа(III.)
· Взаимодействие меди с бромоводородной кислотой.
· Изучение амфотерных свойств оксида меди(I). Растворение в соляной
кислоте, растворах аммиака и гидроксида аммония.
· Изучение амфотерных свойств оксида меди(II). Растворение в соляной
кислоте, растворах аммиака и гидроксида аммония.
· Изучение амфотерных свойств гидроксида меди(II). Растворение в
соляной кислоте, растворах аммиака и гидроксида аммония.
В опытах использовали свежеосажденную медь, оксид меди(I), оксид меди(II), гидроксид меди(II) и бромоводородную кислоту, которые получали непосредственно перед проведением опытов.
В фарфоровую или стеклянную чашку наливали насыщенный раствор сульфата меди(II) и внесли гранулы цинка. Выделяющаяся медь осаждалась на цинке в виде рыхлой массы.
CuSO4 + Zn = ZnSO4 + Cu
При перемешивании раствора осадок скапливался на дне чашки
(рис. 1). Осадок промывали, удаляли гранулы непрореагировавшего цинка; полученную медь, не высушивая, использовали для опытов.
Рис.1. Получение свежеосажденной меди
В пробирку наливали 5 мл десятипроцентного раствора сульфата меди (II) и затем немного больший объем гидроксида калия. К образовавшемуся голубому осадку гидроксида меди(II) добавляли избыток
глюкозы и перемешивали (рис 2, ярко – синий раствор). Смесь нагревали водой с температурой ~100 оС. Наблюдали образование желтого осадка меди(I), оранжевого цвета смеси осадков гидроксида и оксида меди(I). После завершения реакции в пробирке образовался красный осадок оксида меди(I) (рис. 2).
Рис. 2. Получение оксида меди(I).
2C6H12O6 + 2Cu(OH)2 → 2C6H12O7 + 2CuOH + H2O
2CuOH → Cu2O + H2O
Поместили в пробирку раствор гидроксида натрия и нагрели. К горячему раствору приливали раствор сульфата меди (II) до выпадения осадка. Полученную смесь нагревали. В результате получали осадок оксида меди(II) черного цвета.
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
t
Cu(OH)2 = CuO + H2O
В пробирку наливали 5 мл десятипроцентного раствора сульфата меди(II) и затем раствор гидроксида натрия до образования голубого студенистого осадка гидроксида меди(II).
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
А. Взаимодействием разбавленной серной кислоты с бромидами
.
При действии на бромид калия раствором, полученным из трех объемов концентрированной серной кислоты (ρ = 1,84 г/см3) и одного объема воды [6, 7], выделялся бромоводород (рис. 3-1, 4-1):
| Из за большого объема этот материал размещен на нескольких страницах: 2 |
Физические свойства
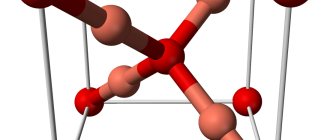
Сульфид меди (I) — твердое вещество темно-серого цвета, нерастворимое в воде и этаноле.
Cu2S существует в трёх кристаллических модификациях:
- α-Cu2S, ромбическая сингония, пространственная группа Ab
2m, параметры ячейки
a
= 1,1190 нм,
b
= 2,728 нм,
c
= 1,341 нм,
Z
= 96,
d
= 5,81 г/см3; - β-Cu2S, гексагональная сингония, пространственная группа P
63/mmc, параметры ячейки
a
= 0,389 нм,
c
= 0,668 нм,
Z
= 2,
d
= 5,78 г/см3; - γ-Cu2S, кубическая сингония, пространственная группа F
m3m, параметры ячейки
a
= 0,5735 нм,
Z
= 4,
d
= 5,60 г/см3.
Температуры фазовых переходов: α → β 103 °C, β → γ 437 °C.
Сульфид меди (I) склонен к образованию нестехиометрических соединений, свойства которых могут сильно отличаться от стехиометрических.
Опыты по химии. Сера и её соединения
Чтобы поделиться, нажимайте
Взаимодействие серы с медью
Медь — неактивный металл. Но при повышенных температурах она активно взаимодействует с серой. Нагреем серу в пробирке до кипения. Сера плавится и постепенно закипает. Пробирка наполняется бурыми парами серы. Опустим медную проволоку в пробирку. В парах серы медь загорается. Продукт взаимодействия – черный сульфид меди.
Cu + S = CuS
Оборудование: штатив, пробирка, горелка, тигельные щипцы.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы с горючими веществами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие серы с натрием
Натрий — активный щелочной металл. Во избежание окисления и взаимодействия с парами воды натрий хранят в керосине. Небольшой кусочек натрия помещает в ступку с порошком серы. Осторожно растираем натрий. Он активно взаимодействует с серой. Продукт реакции – сульфид натрия.
Na + S = Na2S
Оборудование: ступка фарфоровая с пестиком, шпатель, скальпель, пинцет, фильтровальная бумага.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы со щелочными металлами. Во избежании химических ожогов обернуть руку полотенцем.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие серы с цинком
Цинк менее активен по сравнению с натрием. Для протекания реакции с серой необходимо нагревание. Смесь порошков серы и цинка поджигаем. Смесь энергично сгорает с образованием сульфида цинка.
Zn + S = ZnS
Оборудование: шпатель, огнезащитная прокладка, горелка, лучина.
Техника безопасности. Соблюдать правила работы с нагревательными приборами. Опыт проводить под тягой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение пластической серы
Сера – кристаллическое вещество. В кристаллах молекулы всегда расположены в строгом порядке. Сера, измельченная в порошок, сохраняет кристаллическую структуру. Нагреем порошок серы. Сера плавится при температуре 120 градусов и становится легко подвижной желтой жидкостью. При дальнейшем повышении температуры сера начинает темнеть, превращается в темно-бурую, вязкую жидкость – пластическую серу. При быстром охлаждении в воде сера сохраняет пластические свойства. Пластическая сера с течением времени кристаллизуется и твердеет.
Оборудование: пробирка, штатив для пробирок, шпатель, химический стакан, спиртовка, держатель для пробирок.
Техника безопасности. Соблюдать правила обращения с нагревательными приборами. Не допускать попадания расплавленной серы на поверхность стола. При возгорании серы тушить пламя речным песком.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение сероводорода и изучение его свойств
Сероводород – токсичный бесцветный газ с запахом тухлых яиц. Сероводород (H2S) в лаборатории можно получить нагреванием смеси парафина с серой. В пробирку помещаем кусочек парафина и желтый порошок серы, закрываем пробкой с газоотводной трубкой и нагреваем на пламени спиртовки. Выделяющийся сероводород можно обнаружить с помощью влажной универсальной индикаторной бумаги: под действием сероводорода она краснеет. Раствор сероводорода в воде – очень слабая кислота. Пропускаем сероводород через холодную дистиллированную воду. Сероводород частично растворяется, образуется сероводородная вода. Лакмус краснеет в сероводородной воде, это действительно слабая кислота. Качественная реакция на сульфид ион – реакция с ионами свинца, мы проведем похожую ‑ реакцию с ионами меди. При добавлении сульфата меди к сероводородной воде выпадает черный осадок сульфида меди.
CuSO4 + H2S = CuS ↓+ H2SO4
Так же выглядит осадок сульфида свинца. По черному осадку сульфида свинца можно обнаружить сульфид-ион.
Оборудование: пробирки, газоотводная трубка, штатив, штатив для пробирок, шпатель, щипцы, фарфоровые тигли, спиртовка, держатель для пробирок.
Техника безопасности. Следует соблюдать правила обращения с ядовитыми газами. Опыт необходимо проводить в вытяжном шкафу. Соблюдать правила обращения с нагревательными приборами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение сернистой кислоты
Сернистую кислоту можно получить растворением сернистого газа в воде. Для получения сернистого газа понадобится концентрированная серная кислота и медь: в пробирку с концентрированной серной кислотой поместим кусочек меди и нагреем раствор.
Cu + 2H2SO4 = CuSO4 + SO2↑ + H2O
Направим ток сернистого газа в пробирку с водой. При растворении сернистого газа частично происходит реакция с водой, и образуется слабая сернистая кислота.
SO2 + H2O = H2SO3
Пропуская сернистый газ через воду, мы получили сернистую кислоту. Сернистый газ в огромных количествах выделяется из недр Земли у действующих вулканов. Сернистый газ раздражает слизистые оболочки дыхательных путей, вызывает их воспаление, потерю аппетита, в больших концентрациях ‑ потерю сознания. Поэтому обращаться с сернистым газом нужно, соблюдая все меры предосторожности.
Оборудование: пробирки, газоотводная трубка, штатив, штатив для пробирок, пинцет, спиртовка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила обращения с нагревательными приборами. Необходима особая осторожность при работе с концентрированной серной кислотой. Следует соблюдать правила работы с концентрированными кислотами.
Недопустимо вдыхание выделяющегося сернистого газа.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Свойства сернистой кислоты
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
H2SO3 + I2 + H2O = H2SO4 + 2НI
Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка.
Оборудование: пробирки, газоотводная трубка, штатив, штатив для пробирок, пинцет, спиртовка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила обращения с нагревательными приборами. Недопустимо вдыхание выделяющегося сернистого газа.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов .
Отличная статья о том как эффективно бороться с ржавчиной от Levsha1988
Давно хотел попробовать гальванику. Электролизом осаждать цинк на черных металлах. В быту пригодится, да и изучить стойкость к коррозии. Есть наборы для оцинковки в продаже, но они дорогие, за таких мелких 2 пузырька и пары причендалов отдавать деньги. искать еще где продается. Пробуем составить это дело самим.
Покупаем в магазине радиодеталей паяльную кислоту, с содержанием цинка. Состав- хлорид цинка. Цинк растворенный уже в соляной кислоте. Там цинка завались. Стоит в местном магазине литр — 400 руб. Литра хватит на очень много. Сразу там же покупаю ортофосфорную кислоту. Тоже является паяльной кислотой. 50 мл. достаточно.
Делаем 2 электрода.
Первым будем чистить от ржи, и его в идеале делать из нержавейки. Нержавейки в моем барахле не оказалось. Отрезал пластинку от корпуса комп. CDпривода. Припаял к этой пластинке медную проволоку, в кач-ве ручки. На пластинку закрепил материал. Лучше всего войлок (шинели, валенки и пр.) он жестче и не продавливается (иначе КЗ).
Второй электрод делаем для нанесения цинка. Пластинку берем от цинкового днища ранее набранных солевых батареек (снять оболочку у батарейки и вкруговую отпилить дно, очистить от солей и порошка.) (Солевые- самые дешевые батарейки в продаже.) Так же припаиваем к ней медный штырь. и закрепляем войлок.
Нужен будет источник питания.
Тут главное условие — возможность регулировки силы тока. У меня есть самопальный источник от 0 до 24 вольт и стабилизацией тока 0 до 10 ампер. Если такого нету- то можно регулировать ток через лампы ближнего или дальнего света последовательно в цепь.
Начинаем чистить от ржавчины. Тут специально вырастил немного ржавчины, что б потом смыть. Таким методом можно выжирать и куда более злую ржу.
К электроду которым чистим подключаем + источника. К очищаемому объекту — Ставим напряжение 12-15 вольт и отсечку тока в 1.5-2 ампера.
Пропитываем войлок электрода ортофосфорной кислотой.
И начинаем водить по ржавчине.
Начинает шипеть, БП показывает что ток пошел (1.5-2 А). Выделение водорода и активность кислоты- отколупывает и растворяет ржу, которая засела в порах и ржа остается на войлоке. Электрод нужно часто полоскать в воде, и снова пропитывать в свежей ортофосфорной кислоте, т.к то что в руке начинает растворяться, и осаждаться на маховике. а это нам пока не надо.
Вот ржа вычистилась. Голый, чистый металл, на котором видны мелкие неровные коросты, что захавала ржавчина. Все, очистили.
Далее обильно протираем насухо. Обезжириваем ацетоном, пальцами не трогаем.
Берем электрод для цинкования. Подключаем его к тому же + источника. Пропитываем его хлоридом цинка. Ставим на БП отсечку тока 0.2-0.4А. Начинаем быстро не отрывая и не задерживая на месте водить по железяке. Как только появилась легкая, тонкая пленка цинка- ставим отсечку тока в 0.8-1 А и так же быстро водим, пока не получим желаемую толщину покрытия. Регулировка тока дает возможность управлять интенсивностью реакции осаждения цинка. Т.к. не ограничив ток, покрытие будет рыхлым, темным и непрочным.
После оцинковки промываем деталь в воде, потом протираем тряпкой, смоченной в растворе пищевой соды. При реакции соды с остаточной кислотности от хлорида цинка, получается соль вроде. Потом еще раз под водой полоскаем. Сода как нейтрализатор.
Вот теперь оцинковано.
Капал воду, вода так и осталась каплями. По голой стали она растекается, а тут как бы собирается, как будто жирная поверхность.
Вот еще пара примеров оцинкованных железяк.
А теперь делаем тоже самое в реальных ситуациях. Например на кузове автомобиля.
Делал я это полтора месяца назад, езжу много по городу. Оставлял специально как открытые оцинованные места, так и под краской. Ни намека на ржавчину ни там, ни там. И вокруг под краской тоже ничего.
Итак.Слева уже готово. Нужно удалить ржу справа и мелкую чуть выше слева.
Колупаем краску вокруг очагов, я колупал канцелярским ножом, и доходим до того, что видим вокруг нетронутый чистый металл.
Достаточно колупать. Далее нам нужно немного распотрошить черную ржавчину, которая сложно поддается обработке т.к. это другая стадия оксида железа. Для этого шкуркой 500 слегка трем до рыжего цвета. Вот как раз с рыжей и будем работать, т.к. она намного активнее взаимодействует с ортофосфорной кислотой.
Ссе стало чисто, ржа сожралась.
В процессе чистки края «раны» будут слегка обколупываться, т.к. под ними есть тонка пленка окисла, это происходит до того момента, пока не дойдет до того места где краска лежит прочно. У меня почти не отваливалось. Вот голый металл, из за своей чистоты и обезжиренности- при плюсовой температуре и влажном воздухе ржа появится примерно через мин 40-час, поэтому не тянем и быстро приступаем к нанесению цинка. Главное очень тщательно удалить ржу.
Протираем ацетоном место. Ацетон краску почти не берет. да и тереть особо не надо., заряжаем цинковый электрод кислотой и поехали.
Далее как говорил — промываем водой, нейтрализуем раствором соды и смываем все снова водой.
Т.к. цинк не пассивирован- он активен, т.е. взаимодействует с внешними раздражителями, он держаться то будет, будет защищать металл под собой. Это будет происходить пока не истощится слой самого цинка. Это займет довольно много времени.
Если зачищено было качественно, возможно не один год (слой довольно толстый я сделал). Но руки чесались и я решил зарядить аэрограф и подкрасить поверх всего этого (так и видно меньше). К машине отдавалась краска в баллоне, с номером цвета краски (Монте Карло.) С баллона красить я не люблю, тем более у данного экземпляра бешеная форсунка брызжет во все стороны. Решил стравить краски в стаканчик и заправить аэрограф (сопло 0.4 мм). Бачек аэрографа- 5 мл, этого хватило подкрасить в 2 слоя все места где цинковал и сами царапины. Распыл очень тонкий но т.к. краску не разбавлял растворителем- ставил давление в 3.5атм. До лета покататься так, за одним посмотреть как вообще живет краска на цинке, т.к. делал без грунта. Его нет у меня и грунт нужен специальный. А так убрал бельмо, которое бросалось в глаза. Оверспрей дал мата, что немного светлит краску, но если покрутить войлоком то полируется немного, а сам опыл стирается.
Полностью не полировал. До лета пока так.
— где б еще ортофосфорную кислоту найти.
— цинкарь
— и не слова о ТБ… что же вас всех в цинк тянет окунуться… опасность представляет именно процесс гальванизации, при котором выделяются пары цинка, так что ребятки, намордничек — маст хэв! всасываемость через кожу кстати не такая уж и большая, но и перчатки лишними не будут, особенно при работе с ортофосфорной…
Обсудить на форуме…