- Обозначение — O (Oxygen);
- Латинское название — Oxigenium;
- Период — II;
- Группа — 16 (VIa);
- Атомная масса — 15,9994;
- Атомный номер — 8;
- Радиус атома = 60 пм;
- Ковалентный радиус = 73 пм;
- Распределение электронов — 1s22s22p4;
- t плавления = -218,4°C;
- t кипения = -182,96°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 3,44/3,50;
- Степень окисления: +2; +1; 1/2; 0; -1/3; -1/2; -1; -2;
- Плотность (н. у.) = 1,42897 г/см3;
- Молярный объем = 14,0 см3/моль.
Кислород («рождающий кислоты») открыл в 1774 г. Дж. Пристли. Это самый распространенный химический элемент на Земле — массовая доля кислорода в земной коре составляет 47,2%. В атмосферном воздухе доля кислорода составляет 21%, что связано с деятельностью зеленых растений.
Кислород входит в состав многих, как неорганических, так и органических соединений. Кислород необходим для жизнедеятельности всех высокоорганизованных живых организмов: человека, зверей, птиц, рыб. Кислород составляет от 50 до 85% массы тканей животных и растений.
Известны три стабильных изотопа кислорода: 16O, 17O, 18O.
В свободном состоянии кислород существует в двух аллотропных модификациях: O2 — кислород; O3 — озон.
Кислород в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «8», относится к 16(VIa) группе (См. Атомы 16(VIa) группы).
Рис. Строение атома кислорода.
Атом кислорода содержит 8 электронов: 2 электрона находятся на внутренней s-орбитали и еще 6 на внешнем энергетическом уровне — 2 (спаренных) на s-подуровне и 4 (два спаренных и два неспаренных) на p-подуровне (см. Электронная структура атомов).
За счет двух неспаренных p-электронов внешнего уровня кислород образует две ковалентные связи, принимая два электрона и проявляя степень окисления -2 (H2O, CaO, H2SO4).
В соединениях с кислородной связью О-О атом кислорода проявляет степень окисления -1 (H2O2).
С более электроотрицательным фтором кислород отдает свои валентные электроны, проявляя степень окисления +2 (OF2).
Общие сведения
Кислород — это газообразный химический элемент. Он обозначается символом O, имеет атомный номер 8 и атомный вес 15,9994, а его молярная масса 32 г/моль. Формула кислорода О2. Схема электронной конфигурации атома кислорода — 1s 2 2s 2 2p 4. Строение атома кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде.
Он представляет большой интерес, поскольку является важнейшим элементом дыхательных процессов большинства живых клеток и процессов сгорания. Это самый распространённый элемент в земной коре. Почти одна пятая (по объёму) воздуха — это О2. Степень окисления -2.
В нормальных условиях О2 — бесцветный газ без запаха и вкуса. Он конденсируется в светло-голубой жидкости. Это реакционноспособный элемент, который образует оксиды со всеми другими элементами, кроме гелия, неона, аргона и криптона. Он умеренно растворим в воде (30 см3 на 1 л растворяющейся воды) при температуре 20 градусов Цельсия.
Иная эволюция
На данном этапе современная наука не опровергает возможность жизни в иных средах, отличных от земных условий, где за основу построения органической молекулы может быть взят кремний или мышьяк. А среда жидкости, как растворителя, может представлять собой смесь жидкого аммиака с гелием. Что касается атмосферы, то она может быть представлена в виде газообразного водорода с примесью гелия и других газов.
Какие метаболические процессы могут быть при таких условиях, современная наука пока не в состоянии смоделировать. Однако такое направление эволюции жизни вполне допустимо. Как доказывает время, человечество постоянно сталкивается с расширением границ нашего понимания окружающего мира и жизни в нем.
История открытия
Что такое воздух? Древние народы глубоко задумывались над этим вопросом. И это не удивительно, когда понимаешь, насколько важен воздух для многих процессов. Объекты не могут гореть без воздуха. Человек не может выжить без воздуха. На самом деле, древние народы думали, что воздух должен быть «элементом». Но они использовали слово «элемент» в несколько ином значении, нежели современные учёные. Для древних людей элемент был чем-то очень важным и основным. Воздух соответствует этому описанию, наряду с огнём, водой и землёй. Впоследствии многие учёные повлияли на открытие такого элемента, как кислород:
- Первым человеком в Западной Европе, который описал «части» воздуха, был итальянский художник и учёный Леонардо да Винчи (1452−1519). Леонардо отметил, что воздух не полностью расходуется, когда в нем что-то сжигается. Поэтому он сказал, что воздух должен состоять из двух частей: одной части, которая расходуется на горение, и одной части, которая не участвует в процессе. В течение многих лет идеи Леонардо были не очень популярны среди учёных. Проблема заключалась в том, что у первых химиков не было хорошего оборудования, как в современных лабораториях. Им было сложно собрать образцы воздуха, а затем изучить его.
- В начале 1700-х химики начали узнавать больше о воздухе, но несколько окольным путём. Например, в 1771 и 1772 годах Карл Вильельм Шееле изучал влияние тепла на ряд соединений. В одном эксперименте он использовал карбонат серебра (Ag 2 CO 3), карбонат ртути (HgCO 3) и нитрат магния (Mg (NO 3) 2). Когда он нагревал эти соединения, он обнаружил, что выделялся газ. Затем он изучил свойства этого газа и обнаружил, что пламя ярко горело в нём. Он также заметил, что животные в нём могут безболезненно находиться. Не зная этого, Шееле открыл кислород.
- Примерно через два года Джозеф Пристли провёл аналогичные эксперименты, нагревая оксид ртути (HgO) в пламени. Соединение распалось, в результате чего образовались жидкая металлическая ртуть и газ. Когда Пристли проверил новый газ, он обнаружил те же свойства и характеристики, что и Шееле. Пристли даже пытался вдохнуть тот газ, получение которого ему удалось осуществить.
- Антуана-Лорана Лавуазье (1743−94) часто называют отцом современной химии. Он получил это звание по ряду причин. Наиболее важной из них является объяснение, которое он открыл для процесса сгорания (горения). До исследования Лавуазье химики считали, что горящий объект выделяет вещество в воздух. Они назвали это вещество флогистоном. Например, когда горело дерево, химики говорили, что флогистон перешёл из дерева в воздух. Лавуазье показал, что эта идея неверна. Когда что-то горит, это на самом деле происходит реакция с кислородом в воздухе. Горение, сказал Лавуазье, — это просто окисление (процесс, при котором какое-либо вещество соединяется с О2). Это открытие дало химикам совершенно новый взгляд на химические изменения. Теория флогистона постепенно начала вымирать. Начали развитие многие идеи, которые сегодня используются в современной химии.
Некоторые люди думают, что Шееле следует отдать должное за открытие кислорода. Он завершил свои эксперименты раньше, чем Пристли. Но его издатель очень медленно печатал отчёты учёного. Они действительно вышли после отчётов Пристли. Таким образом, большинство историков сходится во мнении, что Шееле и Пристли должны разделить между собой право на открытие кислорода.
Ни Шееле, ни Пристли до конца не понимали важность их открытия. Этот шаг был предпринят французским химиком Антуаном-Лораном Лавуазье (1743−94). Лавуазье был первым человеком, который объявил, что новый газ является элементом. Он был также первым человеком, который объяснил, как кислород участвует в горении. Кроме того, он предложил название для газа.
Слово oxygenium («кислород») происходит от греческих слов, обозначающих «рождающий кислоту». Лавуазье выбрал такое название, потому что думал, что все кислоты содержат О2. Поэтому новый элемент отвечал за «образование кислот». Однако в этом отношении Лавуазье ошибся. Не все кислоты содержат кислород.
Кислород – основа жизни
Из–за высокой окислительной активности кислород достаточно легко соединяется с большинством элементов и веществ, образуя оксиды. Высокая окислительная способность элемента обеспечивает всем известный процесс горения. Кислород также участвует в процессах медленного окисления.
Роль кислорода в природе как сильного окислителя незаменима в процессе жизнедеятельности живых организмов. Благодаря этому химическому процессу происходит окисление веществ с выделением энергии. Её живые организмы используют для своей жизнедеятельности.
Элемент в окружающей среде
Земная кора состоит в основном из кремниево-кислородных минералов, и многие другие элементы присутствуют в виде их оксидов. Газообразный кислород составляет пятую часть атмосферы. О2 в атмосфере Земли образуется в результате фотосинтеза растений, он накапливался в течение длительного времени, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.
Элемент хорошо растворяется в воде, что делает возможной жизнь в реках, озёрах и океанах. Вода в этих водоёмах должна регулярно снабжаться кислородом, поскольку, когда запасы О2 в ней истощаются, она больше не может поддерживать рыбу и другие водные организмы.
Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений. Вода, H2O и кремнезём, SiO2, основной компонент песка, являются одними из наиболее распространённых двойных кислородных соединений. Среди соединений, которые содержат более двух элементов, наиболее распространёнными являются силикаты, которые образуют большинство пород и почв. Другими соединениями, которые в изобилии встречаются в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (боксит) и различные оксиды железа, которые используются в качестве источника металла.
Элемент встречается во всех видах минералов. Некоторые общие примеры включают оксиды, карбонаты, нитраты, сульфаты и фосфаты. Оксиды — это химические соединения, которые содержат кислород и ещё один элемент. Карбонаты — это соединения, которые содержат кислород, углерод и ещё один элемент. В качестве примера можно привести карбонат натрия или соду, кальцинированную соду или солевую соду (Na2CO3), которая часто встречается в моющих и чистящих средствах.
Нитраты, сульфаты и фосфаты также содержат кислород. Другими элементами в этих соединениях являются азот, сера или фосфор плюс ещё один элемент. Примерами этих соединений являются нитрат калия или селитра (KNO3), сульфат магния или соли Эпсома (MgSO4) и фосфат кальция (Ca3 (PO 4)2).
Растения — источник кислорода в атмосфере
На начальном этапе образования атмосферы на нашей планете существующий кислород находился в связанном состоянии, в виде двуокиси углерода (углекислый газ). Со временем появились растения, способные поглощать углекислый газ.
Данный процесс стал возможен благодаря возникновению фотосинтеза. Со временем, в ходе жизнедеятельности растений, за миллионы лет в атмосфере Земли накопилось большое количество свободного кислорода.
По мнению учёных, в прошлом его массовая доля достигала порядка 30 %, в полтора раза больше, чем сейчас. Растения, как в прошлом, так и сейчас, существенно повлияли на круговорот кислорода в природе, обеспечив тем самым разнообразную флору и фауну нашей планеты.
Значение кислорода в природе не просто огромно, а первостепенно. Система метаболизма животного мира чётко опирается на наличие кислорода в атмосфере. При его отсутствии жизнь становится невозможной в том виде, в котором мы знаем. Среди обитателей планеты останутся только анаэробные (способные жить без наличия кислорода) организмы.
Интенсивный круговорот кислорода в природе обеспечен тем, что он находится в трёх агрегатных состояниях в объединении с другими элементами. Будучи сильным окислителем, он очень легко переходит из свободной формы в связанную. И только благодаря растениям, которые путём фотосинтеза расщепляют углекислый газ, он имеется в свободной форме.
Процесс дыхания животных и насекомых основан на получении несвязанного кислорода для окислительно-восстановительных реакций с последующим получением энергии для обеспечения жизнедеятельности организма. Нахождение кислорода в природе, связанного и свободного, обеспечивает полноценную жизнедеятельность всего живого на планете.
Изотопы кислорода
Есть три естественных изотопа О2: кислород-16, кислород-17 и кислород-18. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Известно также пять радиоактивных изотопов элемента. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Воздействие на здоровье
Кислород необходим для всех форм жизни, так как он является составной частью ДНК и почти всех других биологически важных соединений. В лёгких этот элемент поглощается атомом железа в центре гемоглобина в крови и, таким образом, транспортируется туда, где он необходим.
Каждый человек нуждается в этом элементе, чтобы дышать, но, как и во многих случаях, слишком большое его количество вредно. Если человек подвергается воздействию большого количества О2 в течение длительного времени, может произойти повреждение лёгких. Вдыхание 50−100% кислорода при нормальном давлении в течение длительного периода приводит к повреждению лёгких. Люди, которые работают с частым или потенциально высоким воздействием чистого элемента, должны пройти тесты на функционирование лёгких до начала работы и по завершении.
Химические свойства
При стандартной температуре и давлении два атома элемента связываются, образуя диоксид кислорода, двухатомный газ без цвета, запаха и вкуса, с формулой O2. Этот элемент является членом группы халькогенов в периодической таблице Менделеева и является высокореактивным неметаллическим элементом. Он легко образует соединения (в частности, оксиды) почти со всеми другими элементами.
Кислород является сильным окислителем и обладает второй по величине электроотрицательностью среди всех реактивных элементов, уступая только фтору. По массе кислород является третьим по распространённости элементом во вселенной после водорода и гелия и наиболее распространённым по массе элементом в земной коре, составляя почти половину массы земной коры. Свободный кислород химически реактивен, чтобы появляться на Земле без фотосинтетического действия живых организмов, которые используют энергию солнечного света для производства элементарного кислорода из воды.
Элементарный O2 начал накапливаться в атмосфере только после эволюционного появления фотосинтезирующих организмов, примерно 2,5 миллиарда лет назад. Двухатомный газообразный кислород в настоящее время составляет 20,8% от объёма воздуха.
Наиболее важными химическими свойствами кислорода являются:
- Поддержание горения. Он помогает другим объектам гореть. Сжигание древесного угля является примером. Древесный уголь — практически чистый углерод.
- Соединяется с элементами при комнатной температуре. Ржавчина является примером. Ржавчина — это процесс, при котором металл соединяется с О2.
- Реагирует со многими соединениями. Распад — это процесс, благодаря которому некогда живое вещество соединяется с кислородом. Продуктами распада являются в основном диоксид углерода (CO2) и вода (H2O):
Сам О2 не горит. Зажжённая спичка в баллоне с чистым элементом горит гораздо ярче, но кислород не загорается.
Химический элемент кислород: характеристика
Для начала охарактеризуем местоположение данного элемента в периодической системе. Это можно сделать несколькими пунктами:
- Порядковый номер – 8.
- Атомная масса – 15,99903.
- Располагается в шестой группе главной подгруппе второго периода системы.
- Заряд ядра – +8, количество протонов – 8, электронов – 8, нейтронов – 8. Таким образом, получается дважды магическое число, благодаря чему наблюдается устойчивость основной изотопной формы 16О.
- Латинское название элемента – oxygen. Русское – кислород, это название образовано от словосочетания “рождающий кислоты”. Существует и синоним, иногда его называют оксигеном.
Отдельного внимания заслуживает разбор электронного строения атома, так как именно им объясняется устойчивость молекулы и проявляемые физические и химические свойства.
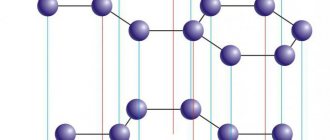
Строение молекулы кислорода
Электронная конфигурация атома представлена формулой 1s22s22p4. Из этой записи очевидно, что до завершения энергетического уровня и создания заветного октета кислороду не хватает двух электронов. Этим объясняются следующие его характеристики:
- молекула кислорода двухатомная;
- степень окисления элемента всегда -2 (кроме пероксидов и оксида фтора, в которых она меняется на -1 и +2 соответственно);
- является сильнейшим окислителем;
- легко вступает в реакции даже при обычных условиях;
- способен образовывать взрывчатые соединения.
Теперь рассмотрим вопрос о строении. Как образуется молекула кислорода? Во-первых, механизм образования ковалентный неполярный, то есть за счет обобществления электронов каждого атома. Таким образом, связь также ковалентная неполярная. При этом она двойная, так как у каждого из атомов есть по два неспаренных электрона на внешнем уровне. Можно очень просто изобразить, как выглядит кислород. Формула следующая: О2 или О=О.
Благодаря наличию такой связи молекула очень устойчива. Для многих реакций с ее участием требуются специальные условия: повышенное давление, нагревание, использование катализаторов.
Как химический элемент кислород – это атом, имеющий три стабильно существующих в природе изотопа. Их массовые числа соответственно равны 16, 17, 18. Однако процентное соотношение очень разнится, так как 16О 99,759%, а остальных меньше 0,5%. Поэтому самый распространенный и устойчивый изотоп – именно с массовым числом 16.
Простое вещество кислород
Если говорить о данном элементе как о простом соединении, то сразу следует обозначить агрегатное состояние при обычных условиях. Кислород – газ, который не имеет ни вкуса, ни цвета, ни запаха. Двухатомная молекула, которая является самым распространенным на планете веществом, после водорода и благородного газа гелия.
Существуют и другие агрегатные состояния этого вещества. Так, при отрицательной температуре -1830С кислород конденсируется в красивую голубую жидкость. Если же превысить порог в -2000С, то жидкость перерастет в ярко-синие кристаллы моноклинной игольчатой формы.
Всего выделяют три основных типа существования кислорода в твердом состоянии.
- Альфа-форма (α-О2). Существует при температуре ниже 200 С.
- Бета-форма (β-О2). Температурный интервал -200-400 С.
- Гамма-форма (γ-О2). Интервал от -400 до -500 С.
Кислород – это один из самых важных и значимых газов. Не только для жизни живых существ на планете, но и для природы в целом. Сложно назвать природный минерал или соединение, в состав которого бы он не входил как элемент.
История открытия кислорода
Первые упоминания о том, что в составе воздуха есть какой-то газ, поддерживающий процессы горения, появилось еще в VIII веке. Однако тогда изучить его, доказать существование и открыть не было технической возможности. Лишь спустя почти тысячелетие, в XVIII веке это было сделано, благодаря работе нескольких ученых.
- 1771 год Карл Шееле опытным путем установил состав воздуха и выяснил, что основные два газа – это кислород и азот.
- Пьер Байен проводит опыты по разложению ртути и ее оксида и официально фиксирует результаты.
- 1773 год Шееле официально открывает элемент кислород, но не получает его в чистом виде.
- 1774 год Пристли независимо от Шееле делает такое же, как и он, открытие, и получает чистый кислород разложением ртутного оксида.
- 1775 год Антуан Лавуазье дает название этому элементу и создает теорию горения, просуществовавшую не одну сотню лет.
- 1898 год Томпсон заставляет общество задуматься о том, что кислород воздуха может закончиться из-за больших выбросов углекислого газа в атмосферу.
- В этом же году Тимирязев доказывает обратное, так как объясняет, что поставщиком кислорода являются зеленые растения планеты.
Таким образом, стало известно, что собой представляет кислород, какой важный и значимый для жизни это газ. После были изучены все физические и химические свойства вещества, рассмотрены способы его получения, просчитано примерное содержание в воде, земной коре, атмосфере и прочих местах планеты.
Физические свойства кислорода
Приведем основные физические параметры, которыми можно охарактеризовать рассматриваемое соединение:
- Кислород – газ при обычных условиях, являющийся составной частью воздуха (21%). Не имеет цвета, вкуса и запаха.
- Легче воздуха, плохо растворим в воде.
- Активно поглощается углем и порошками металлов, растворяется в органических веществах.
- Температура кипения составляет -183 С. Плавления -218,35 С.
- Плотность составляет 0,0014 г/см3.
- Кристаллическая решетка молекулярная.
Кислород обладает парамагнитными свойствами в жидком состоянии.
Химические свойства кислорода
О том, насколько активен рассматриваемый газ, как он ведет себя в реакциях с другими веществами, подробно рассказывает химия. Кислород способен проявлять несколько степеней окисления, хотя наиболее частой является -2, которая считается постоянной. Помимо нее встречаются соединения, в которых значения следующие:
- -1;
- -0,5;
- -1/3;
- +0,5;
- +1;
- +2.
Химическая активность объясняется высоким сродством к электрону, так как значение электроотрицательности по Поллингу у него 3,44. Выше лишь у фтора (4). Поэтому кислород является очень сильным окислителем. В тоже время в реакциях с еще более сильными окислителями ведет себя как восстановитель, проявляя положительную степень окисления. Например, в оксиде фтора O+2 F2- .
Существует огромное количество соединений, в состав которых входит кислород. Это такие классы веществ, как:
- оксиды;
- пероксиды;
- озониды;
- надпероксиды;
- кислоты;
- основания;
- соли;
- органические молекулы.
Со всеми элементами кислород способен вступать в реакцию при обычных условиях, кроме благородных металлов, гелия, неона и аргона и галогенов. С инертными газами он не взаимодействует ни при каких условиях.
Получение кислорода в промышленности
Содержание кислорода в воздухе и воде настолько велико (21 и 88% соответственно), что основным промышленным способом его синтеза является фракционная перегонка жидкого воздуха и электролиз воды.
Особенно часто применяется первый метод. Ведь из воздуха можно выделить очень много этого газа. Однако он будет не совсем чистым. Если же необходим продукт более высокого качества, тогда в ход пускают электролизные процессы. Сырьем для этого является либо вода, либо щелочь. Гидроксид натрия или калия используют для того, чтобы увеличить силу электропроводности раствора. В целом же суть процесса сводится к разложению воды.
Получение в лаборатории
Среди лабораторных методов широкое распространение получил метод термической обработки:
- пероксидов;
- солей кислородсодержащих кислот.
При высоких температурах они разлагаются с выделением газообразного кислорода. Катализируют процесс чаще всего оксидом марганца (IV). Собирают кислород вытеснением воды, а обнаруживают – тлеющей лучинкой. Как известно, в атмосфере кислорода пламя разгорается очень ярко.
Еще одно вещество, используемое для получения кислорода на школьных уроках химии, – перекись водорода. Даже 3 % раствор под действием катализатора мгновенно разлагается с высвобождением чистого газа. Его нужно лишь успеть собрать. Катализатор тот же – оксид марганца MnO2.
Среди солей чаще всего используются:
- бертолетова соль, или хлорат калия;
- перманганат калия, или марганцовка.
Чтобы описать процесс, можно привести уравнение. Кислорода выделяется достаточно для лабораторных и исследовательских нужд:
2KClO3 = 2KCl + 3O2↑.
Аллотропные модификации кислорода
Существует одна аллотропная модификация, которую имеет кислород. Формула этого соединения О3, называется оно озоном. Это газ, который образуется в природных условиях при воздействии ультрафиолета и грозовых разрядов на кислород воздуха. В отличие от самого О2, озон имеет приятный запах свежести, который ощущается в воздухе после дождя с молнией и громом.
Отличие кислорода и озона заключается не только в количестве атомов в молекуле, но и в строении кристаллической решетки. В химическом отношении озон – еще более сильный окислитель.
Кислород – это компонент воздуха
Распространение оксигена в природе очень широко. Кислород встречается в:
- горных породах и минералах;
- воде соленой и пресной;
- почве;
- растительных и животных организмах;
- воздухе, включая верхние слои атмосферы.
Очевидно, что им заняты все оболочки Земли – литосфера, гидросфера, атмосфера и биосфера. Особенно важным является содержание его в составе воздуха. Ведь именно этот фактор позволяет существовать на нашей планете жизненным формам, в том числе и человеку.
Состав воздуха, которым мы дышим, чрезвычайно неоднороден. Он включает в себя как постоянные компоненты, так и переменные. К неизменным и всегда присутствующим относятся:
- углекислый газ;
- кислород;
- азот;
- благородные газы.
К переменным можно отнести пары воды, частицы пыли, посторонние газы (выхлопные, продукты горения, гниения и прочие), растительная пыльца, бактерии, грибки и прочие.
Значение кислорода в природе
Очень важно, сколько кислорода содержится в природе. Ведь известно, что на некоторых спутниках больших планет (Юпитер, Сатурн) были обнаружены следовые количества этого газа, однако очевидной жизни там нет. Наша Земля имеет достаточное его количество, которое в сочетании с водой дает возможность существовать всем живым организмам.
Помимо того, что он является активным участником дыхания, кислород еще проводит бесчисленное количество реакций окисления, в результате которых высвобождается энергия для жизни.
Основными поставщиками этого уникального газа в природе являются зеленые растения и некоторые виды бактерий. Благодаря им поддерживается постоянный баланс кислорода и углекислого газа. Кроме того, озон выстраивает защитный экран над всей Землей, который не позволяет проникать большому количеству уничтожающего ультрафиолетового излучения.
Лишь некоторые виды анаэробных организмов (бактерии, грибки) способны жить вне атмосферы кислорода. Однако их гораздо меньше, чем тех, кто очень в нем нуждается.
Использование кислорода и озона в промышленности
Основные области использования аллотропных модификаций кислорода в промышленности следующие.
- Металлургия (для сварки и вырезки металлов).
- Медицина.
- Сельское хозяйство.
- В качестве ракетного топлива.
- Синтез многих химических соединений, в том числе взрывчатых веществ.
- Очищение и обеззараживание воды.
Сложно назвать хотя бы один процесс, в котором не принимает участие этот великий газ, уникальное вещество – кислород.
Физические свойства
Кислород более растворим в воде, чем азот. Вода содержит приблизительно одну молекулу O2 на каждые две молекулы N2 по сравнению с атмосферным отношением приблизительно от одного до четырёх. Плотность кислорода в газообразном состоянии 1,42897 кг/м3. Другими физическими свойствами элемента являются:
- Газ в нормальном состоянии бесцветный, без запаха и вкуса. Жидкий кислород слегка парамагнитен. Он реактивен и образует оксиды со всеми элементами, кроме гелия, неона, криптона и аргона. Умеренно растворим в воде.
- Элемент конденсируется при температуре -182,95С, а замерзает при -218,79С. И в жидком, и в твёрдом состоянии является прозрачным веществом светло-голубого цвета.
- Существование элемента в двух аллотропных формах. Аллотропы — это модификации элемента с различными физическими и химическими свойствами. Аллотропы О2 — это двухатомный кислород и озон, или трёхатомный. Озон встречается в довольно больших количествах в особых условиях. Например, необычно большое количество озона находится в верхних слоях атмосферы Земли. Этот озоновый слой важен для жизни на планете. Он защищает от вредного излучения, которое исходит от Солнца. Озон на уровне земли бесполезен для жизни и может вызвать проблемы со здоровьем у растений, людей и животных.
- Атомарный кислород очень высоко активен. Он способен окислять атомы элементов, которые несвойственны этому организму, и является одним из сильнейших антиоксидантов, который устраняет кислородное голодание тканей и уничтожает практически любую патогенную микрофлору (грибы, вирусы, бактерии и другие) и лишние свободные радикалы.
Нахождение кислорода в природе
Среди всех элементов нашей планеты наибольшую долю занимает кислород. Распространение кислорода в природе весьма разнообразно. Он присутствует как в связанном виде, так и в свободном. Как правило, являясь сильным окислителем, он пребывает в связанном состоянии. Нахождение кислорода в природе как отдельного несвязанного элемента зафиксировано только в атмосфере планеты.
Содержится в виде газа и представляет собой соединение двух атомов кислорода. Составляет около 21 % от общего объёма атмосферы.
Кислород в воздухе, кроме обычной своей формы, имеет изотропную форму в виде озона. Молекула озона состоит из трёх атомов кислорода. Голубой цвет неба непосредственно связан с наличием этого соединения в верхних слоях атмосферы. Благодаря озону, жёсткое коротковолновое излучение от нашего Солнца поглощается и не попадает на поверхность.
В случае отсутствия озонового слоя органическая жизнь была бы уничтожена, подобно поджаренной еде в микроволновой печи.
В гидросфере нашей планеты этот элемент находится в связанном виде с двумя молекулами водорода и образует воду. Доля содержания кислорода в океанах, морях, реках и подземных водах оценивается около 86- 89 %, с учётом растворенных солей.
В земной коре кислород находится в связанном виде и является наиболее распространённым элементом. Его доля составляет около 47 %. Нахождение кислорода в природе не ограничивается оболочками планеты, этот элемент входит в состав всех органических существ. Его доля в среднем достигает 67 % от общей массы всех элементов.
Применение кислорода
Молекулярный диоксид O2 необходим для клеточного дыхания у всех аэробных организмов. Его реакционноспособные виды, такие как супероксид-ион (O2-) и пероксид водорода (H2O2), являются опасными побочными продуктами использования кислорода в организмах. Однако части иммунной системы высших организмов используют реактивный пероксид, супероксид и синглетный кислород для уничтожения вторгающихся микробов. Реактивные виды также играют важную роль в гиперчувствительной реакции растений на воздействие патогенных микроорганизмов.
В состоянии покоя взрослый человек вдыхает от 1,8 до 2,4 г кислорода в минуту. Это составляет более 6 миллиардов тонн элемента, вдыхаемого человечеством в год. Сферы использования включают в себя следующие:
- Люди, у которых есть проблемы с дыханием, используют кислородные маски и резервуары, чтобы получить необходимый им кислород.
- Он используется в ракетном топливе, сочетается с водородом в двигателе. Когда водород и кислород объединяются, они выделяют очень большое количество энергии. Энергия используется для запуска ракеты в космос.
- На производство металла приходится самый большой процент использования О2. Например, элемент используется для сжигания углерода и других примесей, которые содержатся в железе для производства стали. Небольшое количество этих примесей может быть полезным для стали, но слишком большое делает его ломким и непригодным для использования. Углерод и другие примеси сжигаются при производстве стали путём продувки О2 через расплавленное железо.
- Используется при производстве таких металлов, как медь, свинец и цинк. Эти металлы встречаются в земле в форме сульфидов, таких как сульфид меди (CuS), сульфид свинца (PbS) и сульфид цинка (ZnS). Первым шагом в извлечении этих металлов является превращение их в оксиды. Затем оксиды нагревают с углеродом, чтобы получить чистые металлы.
- Применяется в химической промышленности в качестве исходного материала для производства некоторых очень важных соединений. Иногда этапы перехода от кислорода к конечному соединению являются длительными. Например, газообразный этилен (C2H4) может быть обработан кислородом с образованием этиленоксида (CH2CH2O). Около 60% полученного этиленоксида превращается в этиленгликоль (CH2CH2 (OH)2). Этиленгликоль используется в качестве антифриза и служит отправной точкой при производстве полиэфирных волокон, плёнки, пластиковых контейнеров, пакетов и упаковочных материалов
- Используется в оксиацетиленовой сварке, в качестве окислителя для ракетного топлива, а также в производстве метанола и этиленоксида.
- Растения и животные используют его для дыхания.
- Чистый кислород часто используется для облегчения дыхания у пациентов с респираторными заболеваниями.
Кислород и его соединения играют ключевую роль во многих важных процессах жизни и промышленности
Эволюция и «химия» планеты
Эволюция жизни на планете опиралась на особенности состава атмосферы Земли, состава минералов и наличия воды в жидком состоянии.
Химический состав коры, атмосферы и наличие воды стали основой зарождения жизни на планете и определили направление эволюции живых организмов.
Опираясь на имеющуюся «химию» планеты, эволюция пришла к углеродной органической жизни на основе воды как растворителя химических веществ, а также использовании кислорода как окислителя с целью получения энергии.