Особенности материала
Алюминием называют металл, поверхность которого окрашена в серебристый цвет с легким белым оттенком. Этот материал имеет определенные особенности, с которыми следует заранее ознакомиться. К ним относят следующее:
- Высокий уровень плотности. Изделия, сделанные из такого металла, очень прочные и не подвергаются механическим повреждениям.
- Хорошая теплопроводность. Этот показатель почти такой же, как у серебра, золота или меди.
- Защищенность от коррозийного налета. Алюминиевые конструкции никогда не ржавеют, однако вместо ржавчины на их поверхности может появиться окись.
Общая характеристика
Благодаря характеристикам лимонная кислота участвует в метаболизме всех организмов, способных жить в среде со свободным кислородом. По своим свойствам она является регулятором кислотности и широко применяется при производстве продуктов питания, придавая им легкую кислинку.
Лимонная кислота применяется в пищевых отраслях в качестве антиокислителя и консерванта. Добавка препятствует порче продуктов, исключает появление неприятных запахов, сдерживает рост и развитие микроорганизмов.
Соли и сложные эфиры кислоты называются цитратами. В производстве продуктов и описаниях лимонная кислота известна под шифром Е330-Е333. В соответствии с европейской классификацией разрешена в виде пищевой добавки при производстве продуктов и напитков.
Подробнее о пищевой добавке Е330
Как почистить в домашних условиях
Есть несколько эффективных средств, которые помогут в домашних условиях прочистить алюминиевую поверхность от образовавшегося окисла.
Чтобы устранить окисление, появившееся на алюминиевой поверхности, можно воспользоваться пищевой содой. Главным достоинством такого средства считается его доступность, так как содовый порошок есть практически в каждом доме.
Прежде чем приступить к устранению окислов, необходимо приготовить раствор. Для этого в 300-400 миллилитров водички добавляется 150 грамм соды. Смесь размешивают до образования густоватой кашицы. Приготовленным составом обрабатывают поврежденную поверхность и смывают ее водой.
Кока-кола
Многие считают, что газированные напитки можно использовать только в качестве питья, но это не так. Домохозяйки используют их для удаления ржавчины и окислений с металлических поверхностей. Среди наиболее эффективных напитков выделяют Кока-колу, которая поможет восстановить алюминиевое изделие. Чтобы устранить окислы, поврежденное покрытие помещают в емкость с шипучей жидкостью и оставляют на 40-60 минут. Если окислений много, процедуру продлевают до 2-3 часов.
Щавель
Некоторые пользуются только щавелевой кислотой, однако устранить окислы помогут даже свежие листочки щавеля. Для начала надо в небольшую кастрюлю поместить пучок с щавельными листками и залить их холодной водичкой. Затем емкость устанавливают на газовую плиту и кипятят на протяжении получаса. Когда жидкость закипит, в ней отмачивают алюминиевое изделие.
Процедура длится полтора часа, после чего отмоченную поверхность прополаскивают и протирают досуха.
Лимонная кислота
К эффективным средствам, которые помогают быстро устранить окисления, относят лимонную кислоту. Ее в количестве двух столовых ложек добавляют в литровую емкость, которая наполнена холодной водой. Затем раствор доводят до кипения, проваривают полчаса и снимают с газовой плиты. Чтобы устранить недавно появившиеся следы окислов, поверхность протирают губкой, смоченной в растворе из лимонной кислоты. Для удаления застарелых окислений изделие придется вымачивать в жидкости.
Яблоко
В свежих яблочках есть микроэлементы, которые способствуют удалению окислившихся пятен с любой металлической поверхности. Пользоваться этим способом очень просто. Достаточно разрезать одно яблочко на две равные части, после чего натереть им окисленный след. Через 40-50 минут обработанное покрытие промывают мыльной жидкостью и высушивают. Если пятна остались, процедуру проводят снова.
Горчичный порошок, уксус и соль
Иногда для устранения почернений на поверхности изделий из алюминия используют средства, приготовленные сразу из нескольких компонентов. Эффективным считается раствор, созданный на основе горчичного порошка, уксуса и соли. Компоненты смешиваются для получения однородной смеси, после чего в ней вымачивают губку и протирают окисление. Через 20 минут после нанесения все смывается подогретой водичкой.
Поваренная соль
Чистка алюминиевой посуды может осуществляться при помощи поваренной соли. Для этого в литр подогретой водички добавляется 85 грамм соли. Компоненты перемешиваются до тех пор, пока частички соли полностью не растворятся в водичке. Затем в жидкости вымачивают тряпочку и протирают загрязненный участок. Перед использованием изделия его надо тщательно сполоснуть, чтобы избавиться от остатков соли.
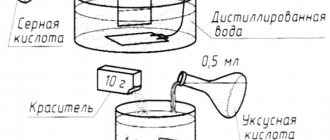
Лимонная кислота, хлорид натрия и цинк / Citric acid, sodium chloride and zinc
Реагирует ли лимонная кислота с цинком? Еще с детства я знал, что из этой идеи не выйдет ничего хорошего. Если реакция и идет — то медленно: практически она непригодна для получения водорода.
Тогда мой набор реактивов был весьма ограничен, что портило жизнь юному химику. Сильных кислот у меня не было, зато цинк и лимонная кислота были в числе легкодоступных. Цинк я доставал из стаканчиков батареек, а лимонная кислота продавалась в продуктовых магазинах и в те времена. Водород получить хотелось, но это я смог только тогда, когда учитель физики подсказал, что в хозяйственных магазинах продается «электролит для кислотных (свинцовых) аккумуляторов», который представляет собой разбавленную серную кислоту. А через пару лет я съездил в соседний город и купил в хозмаге концентрированную серную и концентрированную соляную кислоту. Тогда они не были запрещены (как сейчас), но была эпоха плановой экономики и повального дефицита. Например, в нашем городе не было серной кислоты и соляной кислоты, зато продавалось навалом медного и железного купороса. В соседнем городе кислоты были (покупай — сколько унесешь), но могло не оказаться медного и железного купороса. И так — со многими банальными товарами.
До покупки электролита я знал только «преобразователь ржавчины» — тоже раствор серной кислоты, но с добавкой ингибитора — уротропина. Если погрузить цинк в такую кислоту, то реакция, сперва начиналась, но вскоре выделение водорода ослабевало и практически прекращалось. Собственно, для этого и добавляют ингибитор — чтобы кислота не разрушала металл, а только удаляла со стали ржавчину (или другие оксидные налеты). Ингибитор, как видите, цинк защищал тоже.
Сейчас сильные кислоты у меня есть, но в результате экспериментов с алюминием, лимонной кислотой и хлоридом натрия удалось добиться выделения водорода с заметной скоростью уже при комнатной температуре (см. Лимонная кислота и алюминий (химический детектив). Citric acid and aluminum (chemical detective novel) [ссылка]). Цинк обычно реагирует с кислотами более активно, чем алюминий, поэтому была надежда, что смесь: лимонная кислота — хлорид натрия будет реагировать с цинком с удовлетворительной скоростью. Если это так, то можно будет получать водород исходя из цинка, лимонной кислоты и соли — общедоступных и безопасных веществ.
(Вообще цинк — металл менее активный, чем алюминий, но алюминий защищен оксидной пленкой, а для цинка образование защитной оксидной пленки нехарактерно — для пассивации цинка его нужно обрабатывать в специальных составах).
В 100 мл воды
растворил:
лимонной кислоты — 35 г, хлорида натрия — 30 г
(раствор профильтровал, поскольку соль была каменной с примесями земли). Поместил в этот раствор гранулы цинка при комнатной температуре (около 15°С).
Результат оказался немного неожиданным. В данном случае я был оптимистом, но не настолько…
Итак, гранулы цинка опустились на дно. Вскоре на поверхности цинка началось слабое выделение водорода — значит, цинк тоже реагирует (аналогично алюминию). Выделение водорода со временем значительно усилилось: от поверхности металла поднимались целые цепочки пузырьков газа. Интенсивность выделения водорода была вполне сопоставима с таковой во время реакции между цинком и разбавленной серной кислотой. В частности, пузырьки образовали «газировку» — раствор приобрел белый оттенок от рассеяния света на границе раздела вода/водород.
Коллега при просмотре видео обратил внимание, что потоки пузырьков водорода поднимались в ламинарном режиме: вертикально или почти вертикально (без завихрений). Если реакция кислоты с цинком идет бурно, с разогревом, то часто наблюдается турбулентность.
Ждать растворения цинка или собирать водород я не стал: все и так ясно. Реакция вполне пригодна для «домашнего» получения водорода. Слил раствор с гранул, чтобы использовать его повторно — в аналогичном опыте с железом (для серьезного исследования нужно было приготовить новый раствор лимонная кислота — хлорид натрия, но для «домашних опытов» такая экономия допустима). Гранулы цинка оставил с небольшим количеством раствора до окончания реакции, чтобы посмотреть, что произойдет после прекращения выделения водорода. В результате цинк растворился не полностью (кислоты, которую я оставил в стакане, не хватило), раствор стал бело-мутным, образовался белый осадок, нерастворимый в воде, но легко растворимый в азотной кислоте. По-видимому, это — основный цитрат цинка.
Лирическое отступление, или чем приходится заниматься химику помимо основного предмета. Пока монтировал данное видео, пережил несколько неприятных часов. Пару дней назад слетела операционная система (Windows 7), а загрузочного диска или флешки у меня не было. Попросил в коллег — сделали, но версия Windows 7 там была другая. Когда поставил программу для монтажа видео и необходимые наборы кодеков — все стало, но при попытке смотировать видео программа выдавала сообщение об ошибке — в самом конце создания видеофайала. Ничего не помогало. Программа для монтажа старая (Ulead VideoStudio 11) — никто не обещал, что она будет работать в более новом Windows (в ХР было нормально, а в моей версии Win 7 она уже нередко сбоила).
Попробовал смонитровать видео без сжатия (т.е. без кодека, в нашем случае — xvid_1.3.7), результат: «Недостаточно места на диске». Места хватало, но суть проблемы понял: файловая система винчестера FAT 32 не воспринимает файлы, большие, чем 4 Гб. Задал сохранение на другой винчестер — создать видео удалось, но размер файла 17 Гб(!) при норме 100-150 Мб. Пробую установить программу для конвертирования видео (чтобы сжать ролик подходящим кодеком) — не становится (в этом Windows), искать новую версию программы — нарываться на вирусы. Но раз удалось создать несжатый видеофайл, значит проблема не в ОС, а в кодеках. Тогда удалил xvid кодек и поставил кодек той же версии, но из другого источника — так удалось смонтировать видео.
Гаражные рецепты
Есть несколько гаражных рецептов, которые помогут приготовить средства против окислов.
Кипячение соды
Очистить новые следы окисла поможет обыкновенная кипяченная водичка. Жидкость необходимо заранее закипятить в небольшой кастрюльке. Потом кипяток переливают в тазик, в котором будут отмачиваться все детали, нуждающиеся в очистке. Продолжительность отмачивания длится около 3-4 часов. Затем все изделия промывают и вытирают от остатков водички. Если окислы не исчезли, придется воспользоваться другими, более эффективными средствами.
Плотную окисленную пленку можно устранить при помощи специальной аптечной буры. Чтобы восстановить алюминиевое изделие, выполняют следующие действия:
- в стаканчик с водой добавляют 10-15 грамм буры;
- размешивают в смеси 3-4 капельки нашатырного спирта;
- обрабатывают металлические покрытие приготовленной жидкостью;
- через сорок минут остатки состава смывают с поверхности.
Едкий натр
Снять слой въевшихся загрязнений можно едким натром. К достоинствам этой процедуры относят то, что ее легко провести в домашних условиях. Средство в количестве 150-200 грамм добавляют в 7-8 литров водички и тщательно перемешивают. Необходимо использовать подогретую водичку, температура которой составляет 60-80 градусов. Приготовленным натровым раствором следует помыть деталь.
Кока-кола
Этот газированный напиток обладает отличными очистительными свойствами, которые помогают восстановить загрязненное алюминиевое покрытие. Несколько литров Колы переливают в кастрюлю. Затем в нее кладут изделие и вымачивают его около часа. За это время потемнение должно полностью исчезнуть.
Если Кола не помогла справиться с окислом, значит, придется применить средство поэффективнее.
История открытия и получение лимонной кислоты
Впервые способ получения лимонной кислоты изобрел швед аптекарь Шееле, он смог выделить ее из сока недозрелых лимонов. В соке ее содержание составляет около 10 %. Выделил он ее в виде цитрата в 1784 году. В 1890 году началось промышленное получение лимонной кислоты в Италии на базе цитрусовых.
Сок обрабатывали гашеной известью (гидроксидом кальция). Цитрат кальция осаждался, его выделяли и снова превращали в кислоту с помощью разбавленной серной кислоты.
В 1893 году Вермеер удалось использовать плесень Penicillium для получения лимонной кислоты.
Когда в результате первой мировой войны прекратилась поставка цитрусовых из Италии, американский химик Джеймс Карри обнаружил, что штаммы черной плесени могут быть производителями лимонной кислоты. В 30-40 годах технологический процесс упростили, внедрили автоматизацию и снизили себестоимость получения продукта.
Из чего делают этот вид кислоты можно понять на примере. Можно получить лимонную кислоту самому в домашних условиях. Однако, чтобы получить хотя бы чайную ложку порошка, потребуется много времени и труда.
Как получить лимонную кислоту самому:
- Возьмите 6 лимонов и выжмите из них сок.
- Поставьте емкость с выжатым соком на водяную баню и выпаривайте жидкость в течение 4-5 часов.
- На стенках емкости образуется белый порошок, который и является лимонной кислотой.
Получение лимонной кислоты в промышленности – сложный и трудоемкий процесс.
Из чего делают пищевую лимонную кислоту?
Состав белых кристаллов, используемых в пищевой отрасли, получается путем брожения свекольных или тростниковых отходов сахарного производства с помощью плесневого грибка Aspergillius niger.
Чтобы меласса (тростниковая или свекольная смесь) стала прозрачной, с ней выполняют несколько манипуляций (осветление, кипячение, стерилизация). Иногда в качестве состава сырья для производства используют гидролизат крахмала, прошедший процесс обработки ферментом. В нем меньше примесей, чем в мелассе. Требуется меньше времени для подготовки к производству.
Отдельно выращивают споры грибка, которые должны принимать участие в производстве. Выращенные споры размножаются в специальной среде от 2 до 4 суток. Затем полученные грибы подсушивают, смешивают с активированным углем и раскладывают в стерильные баночки, в которых они могут храниться до двух лет. Подготовленные споры добавляются в очищенную массу. Эта масса затем проходит процесс ферментации в бродильной камере. Через 5-6 суток в камере выделяется максимальное количество продукта, но его не собирают, а добавляют к ней еще мелассы и продляют процесс ферментации до 12 суток, чтобы увеличить процент выхода лимонной кислоты. После такой манипуляции процент выхода увеличивается на 35 %.
Полученная жидкость состоит из смеси кислот. Лимонная составляет в ней 90% массы. Массу нагревают до 100 градусов и добавляют известь, чтобы довести уровень pH до 6,8 – 7,0.
Полученный осадок фильтруют, промывают и обрабатывают серной кислотой. Лимонную кислоту, оставшуюся в растворе после выпадения осадка, очищают активированным углем и смолами. После обработки испарителем и вакуумными кристаллизаторами очищенного раствора получают, наконец, долгожданные кристаллы.
Основным методом производства является также биосинтез, при котором используются кукуруза, маниока, бататы, сельхозотходы. Очищают их активированным углем.
Состав пищевой лимонной кислоты отличается от технической лишь степенью очистки.
Проверенные способы, чем убрать окись с изделий из алюминия в домашних условиях
Изделия из алюминия используются очень широко. Они легкие и удобные, имеют блеск. Но в процессе эксплуатации блеск достаточно быстро сходит, а на поверхности образуется окись, которая сильно портит внешний вид.
Чтобы решить проблему с появившейся окисью, можно использовать специальные средства и народные рецепты, а также придерживаться правил по эксплуатации.
О том, чем убрать окись с алюминия, расскажем в статье.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
2Al + 3H2SO4(разб) → Al2(SO4)3 + 3H2↑.
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
2Al + 6H2SO4(конц) → Al2(SO4)3 + 3SO2↑ + 6H2O.
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
2Al + 6HCl → 2AlCl3 + 3H2↑.
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Al + 6HNO3(конц) → Al(NO3)3 + 3NO2↑ + 3H2O.
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Как очистить подручными средствами?
В процессе использования предметов из алюминия, на их поверхности появляются темные пятна. Убрать окись можно с применением несложных способов чистки.
Лимонная кислота
Для обработки алюминиевой емкости необходимо подготовить раствор в следующей пропорции: на каждый литр воды – 2 столовые ложки лимонной кислоты. Получившийся раствор необходимо прокипятить в течение четверти часа (или немного дольше, если окиси очень много). После этого емкость моют.
Яблоки
Хорошо справляется с окисью фруктовая кислота, которая есть в свежих яблоках.
Порядок действий:
- Плод разрезают пополам.
- Срезом натирают темные пятна.
- Оставляют для воздействия на 30 минут.
- Емкость моют.
Кока-Кола
Сладкий газированный напиток в своем составе содержит ортофосфорную кислоту, которая хорошо справляется с окисью. Применение у Колы очень простое:
- влить напиток в алюминиевую емкость;
- оставить на 1,5 часа;
- промыть.
Щавель
Для обработки необходим свежий щавель. Порядок применения:
- Пучок листьев помещают в емкость, которую необходимо обработать.
- Заливают емкость водой.
- Кипятят на слабом огне полчаса.
- Раствор с листьями выливают.
- Емкость моют.
Соль, уксус и порошок горчицы
Если потемнение от окиси находится с внешней стороны емкости, применить можно следующий способ:
- в мисочку всыпать по 1 столовой ложке соли и горчичного порошка;
- влить 1 ст.л. уксуса;
- размешать;
- используя губку, нанести получившуюся кашицу на участки с окисью;
- оставить на четверть часа;
- промыть теплой водой.
Соль кухонная
Пищевая соль, разведенная водой, также может использоваться для устранения окиси. Порядок работ:
- В мисочку всыпать 2 ст.л. соли.
- Влить 1 ч.л. воды теплой температуры.
- Перемешать.
- Губкой нанести на участки с потемнениями.
- Оставить на 30 минут.
- Промыть.
Содовый раствор
Для устранения окисления с поверхности алюминиевых предметов можно использовать водный раствор соды. Этот рецепт подойдет не только для посуды, но и для устранения потемнения с различных деталей механизмов.
В большую емкость, в которой будут очищаться предметы из алюминия погружным способом, вливают воду и всыпают соду в следующем соотношении: на каждый литр жидкости – 2 столовые ложки порошка.
Порядок обработки:
- заливают содовый раствор в емкость;
- предмет, который нужно обработать, опускают в емкость;
- доводят до кипения;
- кипятят не менее 10 минут, следя за эффектом.
Химические свойства и формула лимонной кислоты
Лимонная кислота активно применяется в пищевой промышленности, в производстве моющих средств, в медицине и в других отраслях народного хозяйства.
Химическая формула и свойства лимонной кислоты обеспечивают ей обширную область применения.
Химическая формула лимонной кислоты — C6H8O7. Мы имеем трехосновную карбоновую кислоту. Химическое вещество лимонная кислота присутствует в клетках большинства живых существ. Она является необходимым компонентом в процессах внутриклеточного метаболизма.
Температура плавления лимонной кислоты — 153°С. При нагревании до 175°С лимонная кислота переходит в аконитовую кислоту, вещество с отличными химическими свойствами, которую применяют для производства фармпрепаратов. Химическая формула аконитовой кислоты С6Н6О6.
В водном растворе с ионами некоторых металлов лимонная кислота имеет свойство образовывать хелатные комплексы, которые отличаются хорошей усвояемостью и входят в состав различных минеральных добавок.
Применение бытовой химии
Для чистки и полировки изделий из алюминия можно найти специальные средства. Их применение дает хороший эффект, но не все из них возможно применять для очищения посуды с внутренней стороны, контактирующей с пищей.
Shine Coins для чистки и полировки
Средство отечественного производства предназначено для чистки и полировки изделий и алюминия и монет. В составе средства присутствуют ПАВ и ультрананодисперсный абразивный компонент, который бережно относится к алюминиевой поверхности.
Перед использованием средство нужно взболтать. Наносить препарат удобно спонжем втирающими движениями. После обработки алюминиевое изделие прополаскивают. Стоимость за объем в 150 мл – от 250 рублей.
Autosol Aluminium Cleaner
Очиститель алюминия – средство автохимии. Производится товар в Германии. Препарат подходит для устранения сложных загрязнений и очагов окисления. Может использоваться для обработки алюминиевой посуды.
Наносится очиститель распылением, действует за 10 минут. После проведенной обработки поверхность чистится и полируется ветошью. Стоимость за 500 мл – от 600 рублей.
Очиститель Мореман
Очиститель алюминия предназначен для устранения следов окисления и других загрязнений с различных алюминиевых поверхностей, в том числе с морских судов. Препарат при контакте с поверхностью дает практически мгновенный эффект.
Кроме окиси, средство убирает известковые отложения, ржавчину и т.д. Очиститель биоразлагаемый. Производитель – Испания. Цена за 1 л – от 1 500 рублей.
Удаление с алюминиевой посуды
Посуда, сделанная из алюминия, подвержена образованию накипи. Это обстоятельство напрямую связано с составом воды из водопровода. Чем больше в ней солей металлов, тем активнее будет образовываться накипь. Для обработки можно использовать те средства, которые есть под рукой.
Лимонная кислота
Для обработки от накипи готовится раствор лимонной кислоты. На каждые 1,5 литра нужно всыпать 25 грамм кислоты. Емкость доводят до кипения и оставляют для остывания. После этого можно промыть внутреннюю часть.
Уксус
Для обработки понадобится столовый уксус. Его разводят пополам с водой или используют неразведенным. Раствор заливают в емкость так, чтобы покрыть участки с накипью.
После доведения до кипения, алюминиевую посуду снимают с огня и дают остыть. Жидкость сливают, а саму посуду моют и кипятят уже с чистой водой.
Свойства лимонной кислоты
Физические свойства
Лимонная кислота представляет собой бесцветные кристаллы ромбической формы. При осаждении из воды при температуре ниже 30°С получается кристаллогидрат С4Н8О7·Н2О.
| Свойство | Описание |
| Внешний вид | Бесцветные кристаллы |
| Молярная масса | 192,12 г/моль |
| Плотность | 1,665 г/см3 |
| Температура плавления | 153,5°С |
| Температура разложения | 175°С |
| Растворимость в воде при 20°С | 133 г/100 г воды (безв.) |
| Растворимость в воде при 100°С | 525 г/100 г воды (безв.) |
Химические свойства
При взаимодействии с основаниями образует соли – цитраты. Как трехосновная кислота, она может образовывать три ряда солей.
Однозамещенные соли называются дигидроцитратами, а двузамещенные соли называются гидроцитратами.
У дигидроцитратов возможны два изомера в зависимости от того, какой атом водорода замещен металлом: в крайней карбоксильной группе или в средней. У гидроцитратов также возможны два изомера в зависимости от того, какой атом водорода остался незамещенным.
Цитраты щелочных металлов легко растворимы в воде и образуют легко растворимые комплексные соли с трудно растворимыми лимоннокислыми солями тяжелых металлов. Цитраты кальция и бария растворимы в холодной воде, но плохо растворимы в горячей.
При нагревании лимонной кислоты со спиртами в присутствии серной кислоты образуются сложные эфиры:
3C2H5OH + НООССН2С(ОН)(СООН)СН2СООН = НООССН2С(ОC2H5)(СООН)СН2СООН + 3H2O.
За счет наличия гидроксильной группы лимонная кислота образует сложные эфиры и с кислотами, например, уксусной:
СН3СООН + НООССН2С(ОН)(СООН)СН2СООН = НООССН2С(ООССН3)(СООН)СН2СООН + H2O
Лимонную кислоту можно окислить до кетоглутаровой перманганатом калия или перекисью водорода:
НООССН2С(ОН)(СООН)СН2СООН + Н2О2 = НООССН2СОСН2СООН + 2H2O.
При нагревании до 175°С она разлагается на аконитовую кислоту и воду:
НООССН2С(ОН)(СООН)СН2СООН → НООССН2С(СООН)=СНСООН + H2О.