В 1790 г. итальянский физиолог Луиджи Гальвани заметил, что лапка препарированной лягушки дергается, если к ней одновременно прикоснуться двумя инструментами из разных металлов. В то время уже было известно, что мышцы могут сокращаться под действием электрического тока, так, что Гальвани правильно приписал это явление действию электрического тока. Правда, он считал, что электрический ток появляется благодаря каким-то физиологическим процессам в лапке лягушки.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока [1]. Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток [2].
Электрическое напряжение, возникающее между электродами, зависит от того, из каких металлов изготовлены электроды и от их взаимодействия с электролитом. Напряжение, даваемое элементом, никак не зависит от площади пластин.
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
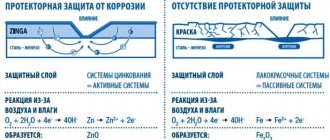
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов [3]. Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
По той же самой причине скручивать вместе медные и алюминиевые провода, это, мягко говоря, не самая лучшая идея. В месте контакта начнется гальваническая коррозия, которая приведет к росту электрического сопротивления контакта, что в свою очередь приведет к большему выделению тепла и еще более быстрой коррозии. Все вместе это может стать причиной разрушения соединения и даже пожара.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.
Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.
Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления [2]. Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода [2]. Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
Земляная батарейка
Навигация — → Электричество →
Для питания и зарядки портативной электроники в тех местах, где нет электросети можно успешно использовать на ряду с другими источниками электроэнергии и простейшие химические источники тока, гальванические первичные и вторичные элементы.
Их использование возможно на дачах при долгосрочном проживании при отсутствии электросети, а так-же в отдалённых деревнях где или нет совсем электроэнергии, или постоянные перебои с электроснабжением.
В советской России химические источники тока или гальванические элементы получили широкое распространение в радиолюбительской технике в середине прошлого столетия, так как эти источники просты в изготовлении и изготовляются из легкодоступных материалов.
Сейчас, когда портативная электроника стала очень экономична в плане электропотребления, её питание от самодельных химических источников тока может оказаться очень эффективным, так как такие источники тока с успехом применяли ещё на заре развития радиотехники.
Тогда техника потребляла в разы больше электроэнергии чем современная аппаратура, а сейчас с развитием энергосберегающей светотехники .
например светодиодной, на освещение тратится в 4-5 раз меньше электроэнергии, чем от потребление обычной лампочки, а так-же современные мобильные телефоны, КПК, и другие гаджеты потребляют не чуть не больше, а даже меньше чем радиоаппаратура прошлых десятилетий.
Простейший гальванический элемент
Вольтов столб Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой.
Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В.
Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги.
В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Планте изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж.
Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом.
Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик.
А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia». Самый долгоживущий гальванический элемент — серно-цинковая батарея, изготовленная в Лондоне в 1840 г.
Подключенный к ней звонок работает и по сей день. (источник ВИКИПЕДИЯ)
Простейший медно-цинковый элемент сосотойт из двух электродов-пластин погруженных в раствор электролита, при погружении в электролит между металлами возникает разница потенциалов, при погружении в раствор повареной соли медной пластины и цинковой возникает разница потенциалов примерно в 1вольт, и один элемент независимо от размеров имеет напряжение в один вольт, а мощьность такого элемента зависит от его размеров и площади пластин погружоннх в электролит.Для получения более высокого напряжение эти элементы, как и зоводские батарейки соеденяют последовательно для получения нужного напряжения.
Характеристики мдно-цинкового элемента
Медно-цинковые источники тока. Производство этих химических источников тока началось еще в 1889 г. В настоящее время они выпускаются в небольших масштабах в виде элементов емкостью от 250 до 1000 А*ч. Гладкие цинковые пластины и пластины из смеси оксида меди, меди и связующего помещают в стеклянный или металлический сосуд с 20%-ным раствором NaОН.
Элементы имеют напряжение 0, 6-0, 7 В и удельную энергию 25-30 Вт*ч/кг. К их достоинствам относится постоянство разрядного напряжения, очень малый саморазряд, безотказность в работе и невысокая цена. Применялись в системах сигнализации и связи на железных дорогах.
В реальных условиях энергоёмкость может сильно отличатся, и зависит она от площади пластит, чистоты металлов и плотности электролита.
Элемент собранный в литровой банке, с пластинами максимальной площади, двадцати процентным раствором соли в виде электролита, выдаёт напряжение от 0, 6-1, 1 вольта, 10-20а/ч, но в таких элементах очень маленький разрядный ток маленький, и ток замыкания может быть около 100-150мА/ч.
, а чем меньше подсоединенный источник потребляет, тем больше медно-цинковый элемент может вырабатывать электроэнергии. Элемент собранный в литровой банке при токе разряда 50мА/ч проработает от 200часов до 400часов и более и более, но со временем пластины окисляются и напряжение падает и в итоге элемент перестаёт работать. Для восстановления элемента надо заменить электролит и очистить пластины от окисления и элемент снова будет работать.
Процесс окисления зависит от разрядного тока чем он выше, тем быстрее элемент выйдет из строя, но в среднем элемент в литровой банке до чистки и перезарядки, при разрядном токе 50 мА/ч проработает около 3-4 месяца, а при разрядном токе в 2-5 мА/ч его хватит на год и более.Простого литрового элемента не хватит для питания даже простого миниатюрного радиоприемника, и для того чтобы получить нужные характеристики нужно собрать блок из нескольких элементов.
Сейчас в основном вся портативная электроника питается напряжением в 3,6-4,5 вольта, и для того чтобы получить такие числа нужно соединить последовательно 4-5 таких элементов, если соединить 5 литровых элементов, то получится примерно3,5-4,8 вольта, и ёмкость возрастает до 40-50а/ч, а ток разряда может достигать 400-600 мА/ч, следовательно такой источник легко справится с питанием маленького радиоприёмника или светодиодного фонарика, а так-же с зарядкой миниатюрных аккумуляторов телефонов в течении 10-30 часов.Но для питания мощных светодиодных фонарей и питания современных телефонов и КПК такого источники будет маловато .
Для стабильного питания понадобится что -то по больше, например элемент ёмкостью как на рисунке, объем 40-50 литров, для стабильного питания портативных комнатных светодиодных светильников и другой техники.
Для изготовления такого химического источника электроэнергии на понадобятся, 5 медных пластин размерами 20/40, и 5 таких-же цинковых, далее на каждую пластинку нужно припаять или запрессовать путём загибания уголка пластины вставить проводок и за плющить молотком.
После надо пластины через электронопроводящие прокладки (деревянный брусочек или пластмассовая трубка) закрепить между собой, потом опускаем их в ёмкости с электролитом, это или раствор поваренной соли, или раствор нашатыря, или раствор серной кислоты(авто электролит), после соединяем получившиеся батарейки последовательно, то есть медная пластина одного элемента через проводок соединяется с цинковой пластиной другого элемента и в итоге с одной стороны получившегося блока остаётся пластина медная с проводком (+), а с другой цинковая (-). Чем больше площадь пластин и чем лучше электролит, тем выше эффективность такого источника тока.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник , представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Вольтов столб своими руками: изготовлние из портативных устройств
. Мы занимаемся установкой заборов, ворот (в том числе автоматических), установкой столбов и линий ЛЭП по всей Москве и Московской области. Звоните c 09:00 до 21:00 ежедневно.
Вольтов столб был изобретён таким известным учёным из Италии, как Алессандр Вольт. Он провел первые испытания химического источника тока еще в 1800 году. Его назвали элементом Вольта.
Он представлял собой сосуд с подсоленной водой и опущенными в неё цинковыми и медными пластинами, которые соединялись проволокой. Потом учёный собрал целую батарею из таких элементов, которая позже была названа Вольтовым столбом.
Вольтов столб своими руками могли сделать любые испытатели и с успехом применяли его.
Принцип действия
Наипростейший медно-цинковый столб собирается из 2 электродных пластин, расположенных в растворе электролита. В этом случае, погружая электролит в пространство между металлами, Вы создаете разницу потенциалов.
Внимание! Если Вы погрузите медные и цинковые пластины в раствор соли, то возникнет разница потенциалов, составляющая приблизительно 1 вольт, тогда как каждый элемент, отдельно взятый в независимости от габаритов, испытывает напряжение в 1 вольт. Помните, что мощность пластин в электролите зависит от площади действия.
Для создания более высокого напряжения или мощности этих элементов заводские батарейки делают в виде последовательно соединённых, количество увеличивают до того, как получат нужное напряжение.
Заводская схема конструкции
История развития конструкции элемента Вольта
Открытие получило развитие в использовании учёных из других стран, которые его успешно применяли в своих исследованиях. К примеру, в 1802 году академик из России Петров собрал батарею — Вольтов столб из 2,1 тыс. элементов, которая обеспечивала электрическую дугу.
В дальнейшем, в 1836 году, химик Дж. Дэниель английского происхождения модернизировал элемент Вольта за счет того, что поместил электроды из цинка и меди в раствор из серной кислоты. Такую конструкцию прозвали как устройство вольтова столба.
Вторая половина девятнадцатого века
Затем в 1859 году во Франции исследователь физических явлений Гастон Планте изобрёл другой тип аккумулятора — свинцово-кислотный. Он до сих пор используется в автомобильных аккумуляторах. Но уже в 1865 году Ж.
Лекланше изобрел свой гальванический элемент, который назвали элемент Лекланше. Он состоял из цинкового стакана, который был заполнен раствором водного хлористого аммония или другой соли хлора.
В него помещали агломерат из оксида (IV)марганца с формулой — MnO2 с угольным токоотводом.
Модификация этой конструкции может использоваться и в современных солевых батарейках в различных бытовых устройствах. В это время в 1890 году в городе Нью-Йорк исследователь Конрад Губерт, который иммигрировал из России, создал 1-й электрический фонарик.
Далее компания National Carbon в 1896 году начинает массовое производство первых сухих элементов имени Лекланше «Columbia» в мире. Самый наибольшее прослужившее гальваническое устройство на серно-цинковой батарее – накопитель, изготовленный в Лондоне во второй половине 19-го года.
Он был подключён к звонку и до сих пор работает.
Стандартная схема простейшей батарейки
Современность
Портативной технике, которой пользуется человек сегодня, необходимо напряжение как минимум в 3,6 вольта (но лучше — 4,5). Для получения такого показателя рекомендуется использовать 4-5 выше описанных элементов, соединенных последовательно.
Когда соединяют 5 литровых (объём электролита) элементов, то добиваются показателя в 3,5-4,6 вольт, при чем ёмкость возрастает до 45-50 ампер в час. Если разряд тока достигнет 400-600 миллиампер в час, то Вы сможете питать такой батарейкой небольшой радиоприемник или фонарик светодиодного типа.
Также можно обеспечить зарядкой миниатюрный аккумулятор телефона до 10-20 часов, но питание современных телефонов и гаджетов потребует более серьезных источников.
Необходимые материалы
Чтобы самостоятельно сделать вольтов столб (химический источник электроэнергии), Вам понадобится:
- ёмкость побольше, например, объемом 40-50 литров (это минимум для стабильного питания портативных светодиодных лампочек и другой техники).
- пять медных пластин 20/40;
- пять цинковых пластин 20/40;
- любая соль.
На подготовительном этапе каждую пластинку припаивают или запрессовывают, загибая уголки пластин. Затем вставляют проводок и заплющивают молотком.
Сборка конструкции химического источника электроэнергии
Закрепите между собой пластины через электронопроводящие прокладки. Для этого подойдут деревянные брусочки или пластмассовые трубки.
Опустите столб пластин в ёмкость с электролитом (раствор поваренной соли, нашатыря или серной кислоты — автоэлектролит). Кислоту добавляют порциями и периодически проверяют плотность раствора аэрометром.
Необходимо добиться, чтобы она составляла 1,21-1,31 грамм на см3 – это приблизительно 280-300 г кислоты.
Модель одного элемента
Далее соедините получившиеся батарейки: медные пластины одного проводком соедините с цинковой полоской второго элемента.
Таким образом, у Вас получится с одной стороны блока — медная полоска закреплена с проводом (+ положительная), а с противоположной — цинковая (отрицательная).
Эффективность такого источника можно повысить за счет увеличения площади пластин, или использования более сильного электролита (серной кислоты).
Технология изготовления альтернативного источника питания
Запомнить:
(1 в среднем: 5,00 из 5)
Принцип действия
Наипростейший медно-цинковый столб собирается из 2 электродных пластин, расположенных в растворе электролита. В этом случае, погружая электролит в пространство между металлами, Вы создаете разницу потенциалов.
Для создания более высокого напряжения или мощности этих элементов заводские батарейки делают в виде последовательно соединённых, количество увеличивают до того, как получат нужное напряжение.
Заводская схема конструкции
Как легко сделать батарейку
Батарейка является химическим источником электрического напряжения. Все имеющиеся в продаже элементы питания имеют похожие принципы действия. Положительный вывод изделия изготавливается из марганца или лития, отрицательный — из цинка или алюминия. Собрать батарейку своими руками можно из простых материалов.
Батарейки это источник электрического напряжения.
Самодельная батарейка из подручных средств
Изготовить элемент питания можно из материалов, свойства которых похожи на характеристики используемых в промышленных условиях веществ.
Из лимона
В роли электролита выступает кислота, содержащаяся в соке фрукта. Электроды делают из тонкой проволоки, гвоздей или игл. Железный элемент является анодом, медный — катодом. Лимон разрезают пополам и помещают в небольшую емкость (банку или стакан). Провода соединяют с электродами, зачищенные концы вводят в мякоть фрукта на расстоянии 1 см друг от друга.
С помощью мультиметра измеряют напряжение, подаваемое самодельным гальваническим элементом. Если оно недостаточно высокое, несколько лимонных батарей соединяют последовательно.
Банка с электролитом
Используя этот метод, можно собрать устройство, напоминающее первый в мире аккумулятор. Электроды изготавливают из меди и алюминия. Элементы должны иметь большую площадь.
Алюминиевый электрод соединяют с проводом с помощью зажима или болта, медный — припаивают. Детали погружают в банку на небольшом расстоянии друг от друга. Для фиксации применяют крышку с отверстиями.
В качестве электролита используют такие составы:
Создание батарей своими руками.
- Нашатырь. Вещество смешивается с водой в соотношении 1:2. Использовать нашатырный спирт в качестве электролита нельзя. Подходящее вещество (хлористый аммоний) имеет вид белого порошка без запаха. Его используют в качестве удобрения или флюса для пайки.
- Раствор серной кислоты. Вещество смешивают с водой в соотношении 1:5.
Нельзя наливать кислоту первой. В таком случае добавляемая вода закипает, брызги попадают на кожу и одежду человека.
Раствор наливают в стеклянную емкость так, чтобы расстояние до краев банки составляло не менее 2 мм. С помощью мультиметра замеряют сопротивление и вычисляют нужное количество батарей.
Принцип действия самодельного элемента сходен с таковым у солевого источника питания.
Медные монеты
Электроды изготавливают из алюминия и меди, в качестве электролита используют уксусную кислоту 9%. Монеты очищают от загрязнений, выдерживая в уксусе. Из картона и фольги вырезают кружки. Картонные изделия вымачивают в растворе уксусной кислоты, они должны впитать электролит. Из кружков и монет выкладывают столбик.
Первой кладется картонная деталь, второй — из фольги, третьей — монета. К крайним элементам заранее подсоединяют провода. Вместо пайки кабели можно прижать к металлическим деталям и заклеить скотчем. При эксплуатации батарейки монета становится непригодной. Не стоит изготавливать источники питания из ценных изделий.
Батарейка в пивной банке
Отрицательным выводом является корпус алюминиевой емкости, положительным — графитовый стержень. Также потребуются угольная пыль, пенопласт, вода, парафиновые свечи и соль.
Верх банки снимают, из пенопласта вырезают кружок, который вставляют в емкость. Заранее проделывают отверстие для стержня. Последний устанавливают в центральной части банки. Оставшееся пространство заполняют угольной пылью.
Материал пропитывают водным раствором соли (3 ст. л. продукта на 0,5 л воды). Края банки заливают парафином.
Картошка, соль и зубная паста
Батарейка из картошки предназначена для разового использования. Ее применяют для получения искры путем замыкания проводов. Для изготовления элемента потребуется крупная картофелина, изолированные медные кабели, соль, деревянные палочки и зубная паста. Сборку выполняют так:
- Картофель разрезают на 2 равные части. В одной половине формируют выемку, куда добавляют соль и пасту.
- Ингредиенты перемешивают до однородной консистенции. Электролит должен заполнить углубление.
- В другой половине картофелины проделывают 2 отверстия на расстоянии 1-2 см. Они должны совпасть с заполненным углублением.
- В отверстия вводят зачищенные концы проводов, половинки совмещают. Провода должны погрузиться в состав.
- Части картофеля закрепляют зубочистками. Через несколько минут кабели замыкают, высекая искру для разведения огня.
Пошаговая инструкция по изготовлению батарейки
Элементы питания цилиндрической формы высотой 50 мм легко изготавливаются в домашних условиях.
Необходимые материалы и инструменты
Перед началом опыта подготавливают такие материалы и инструменты:
- гофрированный картон;
- плоские шайбы из меди диаметром 1 см — 12 шт.;
- плоские шайбы из цинка диаметром 1 см — 15 шт.;
- очищенная вода;
- термоусадочная трубка;
- уксусная кислота 70%;
- поваренная соль;
- паяльник;
- емкости для приготовления растворов;
- мультиметр;
- наждачная бумага.
Гофрированный картон является одним из материалов для создания батареек своими руками.
Зачистка шайб
В основе самодельного элемента питания лежит 11 медно-цинковых шайб, выдающих напряжение в 0,15 В. Детали должны участвовать в химических реакциях, поэтому их очищают наждачной бумагой. В результате получают ровную блестящую поверхность.
Подготовка электролита
Металлы создают электрический ток, однако для его проведения нужна среда. Электролит изготавливают из 120 мл воды, 4 ст. л. соли и 30 мл уксусной кислоты. Ингредиенты перемешивают и настаивают в течение часа.
Работа с картоном
Для формирования нужного расстояния между шайбами выкладывают кружки, вырезанные из гофрокартона. После нарезания материал пропитывают подготовленным на прошлом этапе раствором.
Растягивание трубки
Перед размещением медно-цинковых шайб трубке придают нужный диаметр. С помощью иглогубцев изделие растягивают на 10% от изначального размера.
Тестирование устройства
На медную шайбу накладывают пропитанный электролитом картон. Мультиметр переводят в режим постоянного напряжения. Черный провод подсоединяют к медной детали, красный — к цинковой. На экране прибора должно появиться значение 0,05-0,15 В. Этого достаточно для создании элемента питания из 11 токопроводящих компонентов.
Итоговая сборка батарейки
Элементы укладывают с соблюдением последовательности: медь — цинк — кусок картона. Каждую деталь выставляют перпендикулярно оси трубки. Для удобства шайбы вдавливают тонким стержнем. Установив последнюю деталь, самодельную батарейку сравнивают с заводской. При необходимости вводят дополнительную шайбу из цинка. Трубку прогревают, создавая подобие батарейки. Излишки удаляют.
Монтаж контактов
Прогретым паяльником приваривают к концам полученной конструкции точки из припоя. При установке в гнездо напаянные детали должны касаться контактов держателя батареи.
Материалы изготовления
Базой для изготовления самодельных источников постоянного тока являются портативные аккумуляторные батарейки, аккумуляторы сотовых телефонов или элементы питания ноутбуков. Допускается использование алкалиновых батареек стандарта АА или ААА, а также перезаряжаемых элементов на никель-металлогидридной основе, имеющих аналогичные размеры корпуса.
Дополнительно приобретаются разъем USB и контроллер, поддерживающий стабильное напряжение в цепи питания.
Возможно изготовление конструкций, использующих для восполнения заряда энергию солнечного излучения. В конструкцию изделия включается светочувствительный элемент, преобразующий солнечный свет в электрическую энергию. Панель подключается к блоку управления зарядкой, оснащенному портом microUSB для подключения к внешней цепи питания, поскольку от солнечного излучения аккумуляторную батарею зарядить невозможно.
Все о гальваническом элементе
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье.
По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами.
В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен.
Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку.
В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше.
По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж.
Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока.
В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Способ 2. Фонарь путь осветит, телефон «накормит»
У вас есть фонарик? Сейчас вы узнаете, как преобразовать фонарь, чтобы он не только путь-дорогу освещал, а ещё помогал оставаться на связи.
Зарядное устройство из фонаря
Нам необходимо:
- Фонарь с накопителем на 3,7 В
- Преобразователь напряжения со встроенным USB-выходом
- Контроллер энергозаряда.
- Разбираем фонарик.
- Резистор с подпаянным светодиодом необходимо убрать. Это даёт возможность сменить один из режимов свечения на другой режим — зарядку.
- На то место, где ранее находилась вилочка с целью зарядки фонарика, ставим преобразователь с выходом.
- К контроллеру заряда батареи припаиваем «+» и «-» от батареи. Уже после этого к контактам OUT+/OUT- предоставленного контроллера подпаиваем преобразователь 5 V.
ВАЖНО. Перед этим необходимо высвободить один контакт переключателя и подпаять к нему преобразователь.
- Проверяем работоспособность. Если нужно — перепаиваем.
- Крепим преобразователь и контроллер. Готово!
Вот такой модерн фонаря даст двойное преимущество в походе. И свет есть, и не страшно остаться без связи в любой момент.
Тут главное, всё сделать правильно, фонарик у вас точно найдётся, а дальше — дело техники.
Самодельная батарейка из подручных средств
Батарейка или гальванический элемент – это химический источник электрического тока. Все батарейки, продающиеся в магазинах, по сути, имеют одинаковую конструкцию. В них используются два электрода из разного состава.
Основным элементом для отрицательного вывода (анода) солевых и щелочных батареек является цинк, а для их положительного (катода) – марганец.
Катод литиевых батареек изготавливается из лития, а для анода используются самые различные материалы.
Между электродами батареек расположен электролит. Состав его различен: для солевых батареек, имеющих самый низкий ресурс, используется хлорид аммония. Для изготовления щелочных батареек применяют гидроксид калия, а в литиевых батарейках используется органический электролит.
При взаимодействии электролита с анодом вблизи него образуется избыток электронов, создающий разность потенциалов между электродами.
При замыкании электрической цепи количество электронов за счет химической реакции постоянно пополняется, и батарейка поддерживает протекание тока через нагрузку.
При этом материал анода постепенно коррозирует и разрушается. При полной его выработке ресурс батарейки оказывается исчерпан.
Несмотря на то, что состав батареек сбалансирован производителями для обеспечения долгой и стабильной их работы, изготовить элемент питания можно и самому. Рассмотрим несколько способов, как можно сделать батарейку своими руками.
Способ первый: батарейка из лимона
Эта самодельная батарейка будет использовать электролит на основе лимонной кислоты, содержащаяся в мякоти лимона. Для электродов возьмем медную и железную проволочки, гвозди или булавки. Положительным будет медный электрод, а отрицательным – железный.
Лимон нужно разрезать поперек на две части. Для большей устойчивости половинки кладутся в небольшие емкости (стаканы или рюмки). Необходимо присоединить провода к электродам и погрузить их в лимон на расстоянии 0,5 – 1 см.
Теперь нужно взять мультиметр и измерить напряжение на получившемся гальваническом элементе. Если его недостаточно, то потребуется еще изготовить своими руками несколько одинаковых лимонных батареек и соединить их последовательно с помощью тех же проводов.
Способ второй: банка с электролитом
Для сборки своими руками устройства, похожего по конструкции на первую батарейку в мире, понадобится стеклянная банка или стакан. Для материала электродов используем цинк или алюминий (анод) и медь (катод).
Для увеличения эффективности элемента их площадь должна быть максимально большой.
Провода лучше будет припаять, но к электроду из алюминия провод придется прикрепить заклепкой или болтовым соединением, так как паять его сложно.
Электроды погружаются внутрь банки так, чтобы они не соприкасались друг с другом, и концы их находились выше уровня банки. Лучше их зафиксировать, установив распорку или крышку с прорезями.
Для электролита используем водный раствор нашатыря (50 г на 100 мл воды). Водный раствор аммиака (нашатырный спирт) – это не тот нашатырь, который используется для нашего опыта.
Нашатырь (хлористый аммоний) – это порошок без запаха белого цвета, применяющийся при пайке в качестве флюса или как удобрение.
Второй вариант приготовления электролита – сделать 20% раствор серной кислоты. При этом нужно заливать кислоту в воду, и ни в коем случае не наоборот. Иначе вода мгновенно закипит и ее брызги вместе с кислотой попадут на одежду, лицо и глаза.
При работе с концентрированными кислотами рекомендуется надевать защитные очки и химически стойкие перчатки. Перед тем, как сделать батарейку с использованием серной кислоты, стоит подробнее изучить правила безопасности при работе с агрессивными веществами.
Осталось налить получившийся раствор в банку так, чтобы до краев сосуда оставалось не менее 2 мм свободного пространства. Затем при помощи тестера подобрать необходимое количество банок.
Собранный своими руками элемент питания похож по составу на солевую батарейку, так как содержит хлорид аммония и цинк.
Способ третий: медные монеты
Ингредиентами для изготовления такой батарейки своими руками являются:
- медные монеты;
- алюминиевая фольга;
- плотный картон;
- столовый уксус;
- провода.
Нетрудно догадаться, что электроды будут медные и алюминиевые, а в качестве электролита используется водный раствор уксусной кислоты.
Монеты для начала нужно очистить от окислов. Для этого их потребуется ненадолго опустить в уксус. Затем изготавливаем кружочки из картона и фольги по размеру монет, используя одну из них в качестве шаблона. Вырезаем кружки ножницами, картонные кладем на некоторое время в уксус: они должны пропитаться электролитом.
Затем из ингредиентов выкладываем столбик: сначала монету, затем – картонный кружок, кружок из фольги, снова монету и так далее, пока материал не иссякнет. Конечным элементом снова должна стать медная монета. К крайним монеткам можно заранее припаять провода. Если паять не хочется, то проводки прикладываются к ним, и вся конструкция плотно оборачивается скотчем.
В процессе работы этой батарейки, собранной своими руками, монеты придут в полную негодность, так что не стоит использовать нумизматический материал, представляющий культурную и материальную ценность.
Способ четвертый: батарейка в пивной банке
Анодом батарейки служит алюминиевый корпус банки из-под пива. Катодом – графитовый стержень.
Дополнительно понадобятся:
- кусок пенопласта толщиной более 1 см;
- угольная крошка или пыль (можно применить то, что осталось от костра);
- вода и обычная поваренная соль;
- воск или парафин (можно использовать свечи).
От банки нужно отрезать верхнюю часть. Затем сделать кружок из пенопласта по размеру дна банки и вставить его внутрь, заранее сделав посередине отверстие для графитового стержня.
Сам стержень вставляется в банку строго по центру, полость между ним и стенками заполняется угольной крошкой. Затем приготавливается водный раствор соли (на 500 мл воды 3 столовых ложки) и заливается в банку.
Чтобы раствор не вылился, края банки заливаются воском или парафином.
Для подключения проводов к графитовым стержням можно использовать бельевые прищепки.
Способ пятый: картошка, соль и зубная паста
Такая батарейка – одноразового применения. Она годится для того, чтобы разжечь огонь, замкнув провода накоротко для получения искры.
Для создания картофельной зажигалки понадобится:
- большая картофелина;
- два медных провода в изоляции;
- зубочистки или похожие на них тонкие щепки;
- соль;
- зубная паста.
Разрезаем картофелину пополам так, чтобы плоскость разреза имела максимально возможную площадь. В одной половинке ножом или ложкой выбираем углубление, куда засыпаем соль и добавляем зубную пасту. Смешиваем их между собой до получения однородной массы. Количество «электролита» должно быть вровень с краями углубления.
В другой половинке, которая будет верхней, прокалываем два отверстия на некотором расстоянии между собой таким образом, чтобы они оба попали в углубление с электролитом при сборке «батарейки».
В отверстие вставляем провода, предварительно зачищенные от изоляции примерно на сантиметр. Складываем половинки вместе так, чтобы концы проводов окунулись в электролит.
Зубочистками скрепляем половинки между собой.
Ждем около пяти минут, после этого, замкнув провода между собой, можно высекать искру и разводить огонь.
Все описанные выше способы не являются полноценной заменой батарейки, купленной в магазине. Напряжение на самодельных элементах может колебаться и его величину невозможно точно подогнать. Долго пользоваться ими тоже не получится.
Но где-нибудь в глуши при отсутствии электричества собрать своими руками элемент питания для мобильного телефона или светодиодной лампочки каждому вполне по силам. Естественно, при наличии соответствующих материалов под рукой.
Способы как сделать батарейку в домашних условиях – неплохая иллюстрация работы гальванических элементов. Сборка их своими руками доступна школьникам на уроках физики.