Свойства и получение ацетилена
В условиях атмосферного давления и нормальной температуры ацетилен представляет собой бесцветный газ. Если температура опускается до значения -85 градусов и ниже, то это соединение переходит в другое состояние – твердое. При этом образуются кристаллы. Следует отметить, что в жидком и твердом состоянии ацетилен может легко взрываться под воздействием трения или при ударе (гидравлическом или механическом). Именно это свойство во многом обусловливает его область применения. Реакции горения ацетилена происходят в присутствии кислорода. В результате данного процесса возникает пламя, характеризующееся самыми высокими показателями температуры (3150 градусов) по сравнению с другими видами горючего.
Основным способом получения ацетилена является реакция, в которой взаимодействуют карбид кальция и вода. Данный процесс протекает при показателях температуры около 2000 градусов и является эндотермическим.
Существует такое понятие, как выход ацетилена. Это такое его количество, которое выделяется в результате разложения 1 кг карбида кальция. ГОСТ 1460-56 устанавливает конкретные значения данной величины, которая находится в прямой зависимости от степени грануляции исходного вещества. Таким образом, следствием относительно небольшого размера частиц карбида кальция является снижение выхода ацетилена.
Данная закономерность является следствием наличия в мелких частицах карбида посторонних примесей, например оксида кальция.
Существуют и другие, менее громоздкие, дорогие и энергозатратные способы получения ацетилена. Например, реакция термоокислительного пиролиза метана из природного газа; разложение нефти, керосина и других видов горючего путем электропиролиза.
Хранение и транспортировка
Все способы хранения и транспортировки предусматривают использование баллонов. Они заполняются специальной массой пористой консистенции. Ее пропитывают ацетоном, который хорошо растворяет ацетилен. Применение данного способа позволяет значительно увеличить наполняемость баллона ацетилена и, что немаловажно, понижает его взрывоопасность.
Длительное соприкосновение ацетилена с такими металлами, как медь и серебро, может привести к повышению его взрывоопасности. Следовательно, недопустимо использование материалов, которые могут содержать эти металлы, например в вентилях.
Как правило, баллоны должны иметь специальные вентили, предназначенные именно для хранения ацетилена.
Полного использования всей емкости баллона можно достигнуть, храня пустые емкости так, чтобы ацетон был распределен по всему объему баллона. А это возможно только в горизонтальном положении. Наполнение баллона должно происходить очень медленно, что важно для соблюдения условий химической реакции растворения ацетилена в ацетоне, а в частности ее скорости.
Преимущества растворенного ацетилена
Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %. Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах.
Сварка ацетиленом: проверка
Технология сварки данным газом достаточно проста. Однако при работе с веществом требуется терпение и внимательность. Для сварки обычно используют специальные горелки, с маркировкой 0-5. Ее выбор зависит от того, какой толщиной обладают свариваемые детали. Следует учесть, что чем больше размер горелки, тем больше расход.
Сварка ацетиленом осуществляется только после того, как оборудование будет проверено и отрегулировано. При этом следует обратить внимание на номер наконечника и номер подающей газ форсунки, которая располагается около рукоятки горелки под гайкой. Также следует проверить все уплотнения.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.
Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
Читать также: Что такое экзерсис в хореографии
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой. Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом.
АЦЕТИЛЕН
АЦЕТИЛЕН —
взрывоопасный бесцветный газ, может содержать ядовитые примеси, слаборастворимый в воде, несколько легче атмосферного воздуха (рис. 1 — молекула ацетилена) .
Рис 1. Молекула ацетилена
Первое применение ацетилена было датировано 1836 годом. Именно тогда химик Эдмонд Дэви проводил химические опыты, в том числе и с карбидом кальция. В один из таких дней ученый пытался создать управляемую химическую реакцию, в ходе которой соединил обычную воду с карбидом кальция. Результатом опыта стало выделение неизвестного газа — ацетилена, в дальнейшем имеющего только техническое применение.
Вначале газ был назван иначе — двууглеродистым водородом, что обусловлено его формулой С2Н2. Название «ацетилен» было дано позже, после создания Юстусом Либихом теории о свободных радикалах. Была внимательно изучена кристаллическая решетка газа, которая была похожа на ту, что имеет группа ацетиленов. Соответственно, и название ему было присвоено такое же.
Ацетилен был назван так и по другой причине, связанной с его химической природой. Его формула базировалась на расшифровке другого соединения — уксусной кислоты. Газ, исходя из его формулы, отнесли к производным ацетилена, что в переводе с латинского означает уксус .
Основные области применения ацетилена
1. Сварка и резка металлов. Сварку совершают с помощью горячего пламени, образованного при работе ацетилено-кислородной горелки. Температура такого пламени может достигать 3000 градусов Цельсия и плавить даже листы стали. Такую сварку применяют и для пластмасс, в том числе и при ремонте автомобильных пластмассовых бамперов.
2. Использование в качестве источника яркого, белого света. В данном случае речь идет об ацетилене, получаемом путем взаимодействия карбида кальция и воды. При этом используются автономные светильники.
3. Производство взрывчатых веществ.
4. Газ применяется при огневой чистке металлических поверхностей. Прежде чем обрабатывать металл дальше, с помощью ацетилена можно удалить следы ржавчины, окалину и другие загрязнения.
5. Получение других соединений и материалов, которыми являются уксусная кислота, этиловый спирт, растворители, пластические массы, каучук, ароматические углеводороды.
6. Ацетилен задействуют, чтобы выгибать трубы, уменьшать площадь поперечного сечения трамблеров, придавать корабельным днищам вогнутую форму, готовить изделия к горячей штамповке. Ацетилен незаменим при выгибании и правке огневым методом, при нагреве во время сварки и резки.
7. Применяется этот газ, когда изделия из черных металлов необходимо закалить, чтобы сделать более износостойкими. Закалка происходит, когда определенные участки изделия сначала разогреваются, а потом охлаждаются без повреждения расположенного в середине материала.
8. Для получения технического углерода.
9. В атомно-абсорбционной спектрофотомерии при пламенной атомизации.
10. В ракетных двигателях (вместе с аммиаком) [3].
Применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона (рис. 2 — баллоны с ацетиленом).
Применение в медицине
Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные (см. БЕЗОПАСНОСТЬ) способы анестезии [3].
Рис 2. Баллоны с ацетиленом
Промышленность выпускает два вида ацетилена
— жидкий и в виде газа.
Газообразный ацетилен обладает резким запахом и это дает определенные преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий ацетилен не обладает никаким цветом. У него есть одна особенность — он преломляет цвет.
Ацетилен и жидкий, и газообразный представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв (см. ВЗРЫВ) может произойти в любую секунду, даже при комнатной температуре.
Для повышения безопасности при обращении с ним применяют так называемую флегматизацию. То есть в емкости, предназначенной для хранения ацетилена, размещают пористое вещество, которое снижает его опасность [3].
Литература
1.
Миллер С. А.Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969.
2.
Хвостов И. В. Ацетилен// Химическая энциклопедия: Гл. ред. И. Л. Кнунянц – М.: Советская энциклопедия, 1998.
3.
Корольченко А. Я., Корольченко Д. А.Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. –М.: Ассоциация «Пожнаука», 2004.
Правообладатель:
Портал про пожарную безопасность propb.ru.
Правила использования материалов портала (сайта) PROPB.RU
← ПредыдущаяСледующая →
Возврат к списку
Карбидные лампы
Название «карбидная лампа» обусловлено использованием в качестве источника света открытого пламени струи сжигаемого ацетилена. Он, соответственно, получен в результате взаимодействия карбида кальция с водой.
Такие лампы были широко распространены в прошлом. Их можно было увидеть на каретах, автомобилях и даже велосипедах. В современное время карбидные лампы используют только в случае острой необходимости в мощном автономном светильнике. Так, спелеологи часто пользуются ими. Отдаленные маяки снабжают именно такими лампами, ведь такой тип освещения намного выгоднее, нежели подведение линий электропередач. Достаточно распространенным является использование таких ламп на судах дальнего плавания.
Ацетилен: применение в медицине
Как используется вещество в этой сфере? Общая анестезия предполагает применение алкинов. Ацетилен является одним из тех газов, которые используются при ингаляционном наркозе. Но повсеместное его применение в этом качестве осталось в прошлом. Сейчас появились более современные и безопасные способы анестезии.
Хотя следует отметить, что и применение ацетилена не представляло большой опасности, так как прежде чем значение его концентрации во вдыхаемом воздухе дойдет до опасного предела, нижний порог горючести будет пройден.
Самым главным условием использования данного газа является соблюдение мер безопасности. Сложно переоценить, насколько опасен ацетилен. Применение его возможно только после проведения всех необходимых инструктажей с работниками различных сфер, в которых он используется.
Ацетилен в условиях нормальной влажности воздуха и температуры является бесцветным газом, который получают в стационарных генераторах методом действия воды на карбид кальция. При понижении температуры до -85 градусов по Цельсию вещество переходит в твердое состояние, одновременно с этим образуются кристаллы. Важным свойством ацетилена является то, что при ударах или под воздействием трения он взрывается. Этот параметр во многом определяет область использования.
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3.
Сварочные работы с использованием ацетилена
Традиционно этот газ применяют при проведении процедуры по автогенной сварке, а также резке металлов. Технология подразумевает использованием двух баллонов с газом, в одном из которых находится кислород, а в другом — ацетилен. Вещества поступают в специализированную горелку, и при сгорании образуется очень горячее пламя. Его температура может достигать 3200 градусов по Цельсию. Самым «эффективным» считается сочетание газов, при котором в смеси содержится 45% ацетилена. При таких условиях удается оперативно расплавить даже достаточно толстые куски листовой стали.
Чем опасен ацетилен
Применение ацетилена ограничено его необычайными свойствами. Этот газ самовоспламеняется. Происходит это при температуре 335°С, а его смесь с кислородом – при температуре от 297 до 306°С, с воздухом – при температуре от 305 до 470°С.
Стоит отметить, что ацетилен технический взрывоопасен. Это было происходит при:
Повышении температуры до 450-500°С, а также при давлении в 150-200 кПа, что равно 1,5-2 атмосферам.
Смесь ацетилена и кислорода при атмосферном давлении также опасна, если ацетилена в ней содержится 2,3-93%. Взрыв может произойти от сильного нагрева, открытого пламени и даже от искры.
При подобных же условиях происходит взрыв смеси воздуха с ацетиленом, если в ней содержится 2,2-80,7 % ацетилена.
Если газ долго соприкасается с медным или серебряным предметом, то может образоваться ацетиленистое взрывчатое серебро или же медь. Это вещество очень опасно. Взрыв может произойти от сильного удара или же в результате повышения температуры. Работать с газом следует осторожно.
Использование в промышленности и быту
Впрочем, автогенная сварка и резка металлов — не единственная сфера применения. Достаточно часто ацетилен используют в качестве источника яркого белого света в автономных приборах освещения. В данном случае его получают с помощью реакции воды и карбида кальция.
Такие лампы были крайне востребованы в прошлом столетии, ими освещали кареты и автомобили. Но и сегодня карбидные устройства, то есть созданные с использованием ацетилена, применяют при благоустройстве отдаленных маяков. Ключевое преимущество карбидных ламп — экономичность и отсутствие необходимости в подключении к электросети. Соответственно, при их установке на маяке не возникает необходимости в подведении линии электропередач, то есть оплате дорогостоящей услуги. Также лампы востребованы на судах дальнего плавания.
Ацетилен используют в промышленности. Его применяют при получении различных продуктов органического синтеза. Например, его используют для создания:
- уксусной кислоты;
- синтетического каучука;
- растворителей;
- некоторых видов пластмасс.
Следует отметить, что ацетилен нашел применение и в медицине, например, его иногда используют при ингаляционном наркозе.
Содержание
- 1 Получение
- 1.1 В лаборатории
- 1.2 В промышленности
- 1.2.1 Получение пиролизом
- 1.2.1.1 Электрокрекинг
- 1.2.1.2 Регенеративный пиролиз
- 1.2.1.3 Окислительный пиролиз
- 1.2.1.4 Гомогенный пиролиз
- 1.2.1.5 Пиролиз в струе низкотемпературной плазмы
- 1.2.2 Карбидный метод
- 2 Физические свойства
- 3 Химические свойства
- 4 История
- 5 Применение
- 6 Безопасность
- 7 Примечания
- 8 Литература
- 9 Ссылки
Читать также: Резьба дереву нихромовой струной
Производство ацетилена пиролизом метана.
БИЛЕТ №1
Вопрос 1.) Методы получения ацетилена в зависимости от способа подвода тепла пиролизом.
Производство ацетилена пиролизом метана.
2CH4 ↔ С2Н2 + 3Н2 ; C2H6 ↔ C2H2 +2H2
Эти р-ции эндотермичны, равновесие–вправо только при 1000-1300оС. Однако для ускорения пр-сса требуется более высокая температура 1500-1600оС для метана и 1200оС для жидких углеводородов. Поэтому главная проблема– подвод тепла.
В полученном газе, кроме C2H2, низших парафинов и олефинов, содержится небольшое кол-во бензола и производных ацетилена (метилацетилен СН3-С≡СН, диацетилен СН≡С-С≡СН и др.).
При Т=1200-1600оС идет разложение части C2H2 на С и Н2: 2СН4 — 3H2→ С2Н2 → 2С + Н2
Уменьшение выхода сажи – путем снижения конверсии метана, что достигается уменьшением времени контакта (до 0,01 с). Далее проводится быстрая “закалка“ реакционных газов впрыском воды, при этом их темп-ра снижается, и разложение C2H2 предотвращается.
В зависимости от метода подвода тепла различают:
1. Электрокрекинг углеводородных газов;
2. Пиролиз в реакторах регенеративного типа с огнеупорной насадкой;
3. Окислительный пиролиз;
4. Пиролиз в потоке газообразного теплоносителя (гомогенный п-з);
5. Пиролиз в струе низкотемпературной плазмы.
а) Электрокрекинг метана
Под действием эл.дуги с Т=2000-3000оС в печах идёт нагрев СН4 до 1600оС, в рез-те получается ацетилен С2Н2: 2СН4→ СН≡СН + 3Н2
Метан подается в реактор тангенсально, проходит через эл. дугу и выходит на “закалку”.
Основной недостаток – высокий расход эл/энергии(до 13000 кВт на 1 т. C2H2). Выход ацетилена 50%.
Сущ-т 2 модификации:
а) Двухстадийный процесс Huls: ацетилен(1500оС) охлаждается сначала жидкими у/в(идет крекинг до этилена) до 1000оС, затем водой до 200оС.
б) Процесс Du Pont: газообразное или испаренное жидкое сырье в смеси с Н2 (1:4) подвергают пиролизу во вращающейся эл. дуге постоянного тока. Здесь большой «+» – расход Е 6500 кВт на 1 т С2Н2. Самое лучшее сырье – бутан(выход С2Н2 75%, а образование сажи не более 2%).
б) Регенеративный пиролиз
Это периодический процесс(Вульф) – в 2 цикла:
I цикл – разогрев насадки (глинозем) печи путем сжигания метана при 1350-1400оС;
II цикл (крекинг)– через разогретую насадку пропускают метан, идет крекинг, далее – охлаждение.
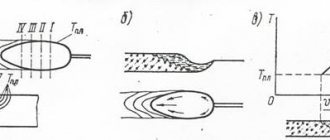
Процесс идет в попеременно работающих горизонтальных печах. Печь состоит из двух одинаковых секций (правой и левой) с огнеупорной насадкой. Цикл работы – из четырех фаз. Схема работы печи представлена на рис 3.
Остаточное давление 0,05 МПа, разбавляя сырье водяным паром или смешивая его с рециркулирующими газами пиролиза, из которых выделен С2Н2. Время пребывания в зоне реакции – 0,03 с. Температура выходящих дымовых газов и газов пиролиза равна 370оС. Метан не разлагается полностью за один проход, поэтому применяют рециркуляцию.
Рис. 3. Схема работы горизонтальной печи фирмы Wulf.
1,2,3,4 – различные положения двух работающих печей; I – подогрев воздуха, II – нагрев насадки, III – пиролиз, IV – нагрев насадки газами пиролиза.
в) Окислительный пиролиз
Здесь СН4 смешивается с О2, при этом часть сырья сжигается, и за счет выделившегося тепла сырье нагревается до 1600оС:
11 СН4 + О2 → 2С2Н2 + 6СО + 14Н2 + СО2 + 6Н2О
Выход ацетилена ≈30%.
Самый экономичный, крупномасштабный. Также наряду с ацетиленом образуется еще и синтез-газ (СО + Н2), используемый при производстве спиртов, метанола и других ценных продуктов.
Особенность процесса– выделение большого количества Q в малом реакционном объеме при частичном сжигании сырья. Это тепло должно быть быстро и равномерно распределено по всему объему зоны реакции, чтобы горение было равномерным по всей реакционной зоне. Для этого нужно предварит-е смешение сырья и О2 и создание условий, при которых горение не началось бы до того, как смесь попадет в зону реакции. Соотношение О2 и сырья близко к нижнему пределу воспламенения; конструкция реактора должна обеспечивать стабильность пламени и равномерное его распределение по сечению реактора.
Тореакции пиролиза 1450-1500оС, время реакции 0,003-0,01с. Для закалки на выходе из зоны реакции впрыскивается вода. Доля О2 – 65% (об.) от доли СН4. Сырье должно быть без СО, Н2 и высших у/в(иначе загорится до реактора).
{ Реакторы для окислительного пиролиза состоят из камеры смешения, в которую раздельно подают кислород и метан, одноканальной или многоканальной горелки, реакционной камеры и закалочного устройства. На рис 4. изображен многоканальный реактор фирмы BASF. Углеводородный газ и воздух, обогащенный кислородом, предварительно нагретые до 600оС, раздельно поступают в горловину 2 и затем в смесительную камеру 3, где происходит их полное смешение. Далее смесь газа и кислорода через многоканальную горелочную плиту 4 поступает в реакционную камеру 5, где происходит частичное сжигание метана и реакция пиролиза. Для обеспечения безопасной работы реактора скорость движения реакционной смеси должна значительно превышать скорость распространения фронта пламени в газе. (Температура реакции пиролиза достигает 1450-1500оС, продолжительность реакции 0,003-0,01 с.) Для закалки на выходе из зоны реакции впрыскивается вода.}
Рис. 4. Многоканальный реактор фирмы BASF для получения ацетилена окислительным пиролизом: 1 – клапан, регулирующий подачу кислорода; 2 – горловина; 3 – смесительная камера; 4 – горелочная плита; 5 – реакционная камера; 6 – запальное устройство; 7 – манометр.
Cхема получения ацетилена окислительным пиролизом метана.
Сырье (природный газ), не содержащее СО, Н2 и высших у/в (иначе оно преждевременно воспламеняется), в подогревателе 1 нагревается до 600оС и поступает в верхнюю часть реактора 3 (в смесительную камеру горелки). Туда же подают подогретый до 600оС кислород – до 65% (об.) от метана. В результате горения То в реакторе повышается до 1500оС. Продукты реакции охлаждают водой до 80оС.
Рис. 5. Схема получения ацетилена окислительным пиролизом метана: 1,2 – подогреватели; 3 – реактор; 4 – скруббер; 5 – коксовый фильтр; 6 – бункер; 7 – циклон; 8,11 – гидравлические затворы; 9 – отстойник; 10 – насос; I – метан; II – кислород; III – топливный газ; IV – воздух; V – конденсат; VI – вспомогательный кислород; VII – газ пиролиза; VIII – вода; IX – в канализацию; X – на факел; XI – вода для транспортирования кокса.
На горение расходуется 55% СН4, на образование ацетилена 23-25%; степень конверсии СН4 – до90%, степень конверсии О2 – более 99%. Сод-е С2Н2 в газе пиролиза – до 10% об.
Окислительный пиролиз является самым распространенным процессом получения ацетилена из углеводородного сырья. Однако применение его наиболее целесообразно в тех случаях, когда можно использовать образующийся синтез-газ (смесь водорода и оксида углерода).
г) Гомогенный пиролиз Здесь часть сырья сжигают в смеси с кислородом в топке печи, газ приобретает температуру 2000оС. В среднюю часть печи в газовый поток вводят остальное сырье, предварительно нагретое до 600оС. Происходит крекинг сырья с образованием ацетилена.Преимущество – в большей безопасности и надежности работы печи, но для ее изготовления нужны огнеупорные материалы.
Можно комбинировать с другими процессами пиролиза, если в горячие газы первой ступени пиролиза вводить пары жидких углеводородов, для расщепления которых в ацетилен требуется более низкая температура. Возможно совместное получение этим методом ацетилена и этилена.
д) Пиролиз в струе низкотемпературной плазмы
Этот процесс находится в стадии разработки, но пока не реализован в промышленности. Является перспективным, так как характеризуется очень высоким выходом ацетилена и сравнительно небольшим расходом электроэнергии (5000-7000 кВт-ч). Сущность процесса: метан вводят в струю низкотемпературной плазмы, где под влиянием высоких температур и ионизированного газа происходит его пиролиз.
Плазма – это энергетически нейтральный ионизированный газ (аргон, водород), состоящий из электронов, атомов и ионов; образуется в электродуговом разряде.
При пиролизе метана в плазменной струе достигается высокий выход С2Н2. Конверсия метана в ацетилен достигает 87% в аргоновой плазме и до 73% в водородной плазме при суммарной конверсии метана до 99 и 94% соответственно. Кроме ацетилена в газе содержатся водород, этилен, этан и пропан.
Сравнение методов получения ацетилена
Основные недостатки карбидного метода – большой расход электроэнергии на получение карбида кальция, многостадийность (СаСО3 à СаО à СаС2 à С2Н2) и значительные капиталовложения в производство. Достоинство метода – в получении концентрированного ацетилена. Кроме того, получение карбидного ацетилена основано на недефицитном каменном угле.
При получении ацетилена пиролизом углеводородов процесс протекает в одну стадию, требует меньших капиталовложений и затрат электроэнергии (кроме электрокрекинга). Однако концентрация ацетилена в конечных продуктах низкая, и его сложно выделить и очистить.
Вопрос 2.) Сернокислотная гидратация низших олефинов. Особенности проведения стадии абсорбции. Схема пропилена + Н2SO4à пропанол.
В настоящее время метод сернокислотной гидратации низкомолекулярных олефинов (этилена, пропилена, бутиленов) широко используется в промышленности для производства низших спиртов. Гидратация олефинов является обратимым процессом и протекает в две стадии: абсорбция олефинов серной кислотой и гидролиз алкилсульфатов.
1. Абсорбция олефинов серной кислотой:
Диалкилсульфат может реагировать с серной кислотой с образованием алкилсульфата:
Выбор условий процесса:
Каталитическое действие кислот в реакции гидратации олефинов связано с образованием алкилсульфатов, поэтому температурная область реакции зависит от природы и строения олефинов, их способности реагировать с серной кислотой. Из газообразных олефинов трудней всего реагирует с серной кислотой этилен, легче бутилен, пропилен и очень легко изобутилен, который поглощается в 500 раз быстрее, чем пропилен и нормальные бутилены.
Выбор условий реакции сульфатирования обусловлен не только скоростью абсорбции олефинов серной кислотой, но и развитием побочной реакции — полимеризации олефинов. Поэтому для каждого олефина подбирают свои условия: концентрацию Н2SО4, температуру и давление. С увеличением молекулярной массы олефина температура абсорбции понижается. Так для этилена температура абсорбции 65—75°С, для пропилена – 65-70, для н-
бутилена – 45, для изобутилена – 30оС; для тех же олефинов давление соответственно также снижается: 2,5; 0,8; 0,3 и 0,3 МПа.
Другим важным показателем является степень насыщения олефина серной кислотой. От этого зависит количество моно- и диалкилсульфатов. При избытке олефина повышается количество диалкилсульфата, но снижается расход кислоты. Это важно, так как после гидролиза серная кислота получается в разбавленном виде и уменьшение ее расхода сказывается на экономике производства. Поэтому соотношение серная кислота — олефин обычно берут равным 1-1,2:1,4.
Скорость абсорбции олефинов серной кислотой зависит от давления. При использовании этан-этиленовой фракции, содержащей 50—60% этилена, общее давление системы 2,5-3 МПа. Давление способствует увеличению скорости поглощения этилена серной кислотой. Время абсорбции 3 часа.
2. Гидролиз алкил- (1) и диалкилсульфатов (II).
Кроме того, (II) может реагировать с образовавшимся в зоне реакции спиртом с выходом простого эфира (III) и алкилсульфата (I):
Образование простого эфира (III) возможно также путем взаимодействия (II) с водой:
Гидролиз проводят при давлении 0,4—0,5 МПа и температуре 92—95° С. Для уменьшения выхода эфира (III) гидролиз ведут по возможности быстро и образовавшийся спирт быстро отгоняют от смеси, чтобы его концентрация в растворе была небольшой. Можно поступать и иначе. Реакционную смесь разбавляют водой, серная кислота и алкилсульфаты переходят в раствор, а диалкилсульфат выделяется в виде нижнего слоя. Выход спиртов 96—97%, простого эфира образуется 1—2%.
Преимущества и недостатки процесса.
Недостатком метода сернокислотной гидратации является участие в процессе больших объемов серной кислоты, ее разбавление, а отсюда необходимость ее упаривания, перекачки больших объемов, что связано с коррозией аппаратуры и большими капитальными затратами на сооружение заводов.
Следует отметить, что процесс сернокислотной гидратации олефинов позволяет проводить реакцию не с концентрированными олефинами (95—98% степени чистоты), как это имеет место при прямой гидратации, а с фракциями олефинов, где содержание олефинов 30—50%. Это основное преимущество метода сернокислотной гидратации.
По капиталовложениям и себестоимости продукции методы сернокислотной и прямой гидратации олефинов примерно одинаковы.
Технологическая схема метода сернокислотной гидратации пропилена
Серную кислоту требуемой концентрации подают на верхнюю тарелку абсорбера 1, в нижнюю часть которого направляют олефины, предварительно сжатые до заданного давления. В абсорбере происходит образование алкилсульфатов и их частичный гидролиз. Часть жидкости со средних тарелок колонны насосом 2 передают на верхнюю тарелку. Газ, выходящий из абсорбера 1, содержит брызги кислоты, пары спирта и эфира, поэтому его после снижения давления в дроссельном вентиле 3 промывают в скруббере 4 водой, которая используется затем на стадии гидролиза. Реакционная масса с низа абсорбера 1 проходит редукционный вентиль 3, где ее давление снижается до 0,15 МПа и поступает в смеситель-гидролизер 5, куда подают воду из скруббера 4 .
Рис. 33. Принципиальная технологическая схема производства изопропилового спирта сернокислотной гидратацией пропилена.
1 — абсорбер; 2 —
насос; 3
—
дроссельный вентиль, 4
—
скруббер; 5 — смеситель-гидролизер, 6
—
гидролизноотпарная колонна; 7 — нейтрализатор; 8
—
холодильник-конденсатор; 9
—
промыватель;10—сепаратор; 11
—
сборник.
Разбавленная масса попадает затем в гидролизно-отпарную колонну 6,
где завершается гидролиз алкилсульфатов и отделяются спирт, эфир и полимеры. Пары воды, спирта и полимеров из гидролизера 6 содержат примеси кислотного характера, поэтому их направляют в нейтрализатор 7 тарельчатого типа, в который вводят 5%-ный раствор NаОН. Подачей в нейтрализатор острого пара предотвращается конденсация продуктов реакции. Они конденсируются затем в холодильнике-конденсаторе 8
.
Подученный конденсат представляет собой водный раствор спирта и эфира, содержащий эмульсионные полимеры. Для их отделения конденсат направляют в сепаратор 10, в котором за счет дополнительного разбавления водой из промывателя 9 и отстаивания полимеры полностью отделяются. В промывателе 9 водой извлекают спирт и эфир, захваченные полимерами, причем промывная вода используется в сепараторе 10 для разбавления конденсата и более полного отделения полимеров.
Водный раствор спирта (обычно около 25%) и эфира (3— 5%) собирают в сборнике 11, откуда направляют на ректификацию. По аналогичной схеме получают этиловый спирт.
1Следующая ⇒
Поиск по сайту:
Получение
В лаборатории
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья – метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы .
Получение пиролизом
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000-3000°С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600°С. Расход электроэнергии составляет около 13000 кВт*ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50%.
Иное название – Вульф-процесс. Сначала разогревают насадку печи путем сжигания метана при 1350-1400°С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным как считалось на стадии проектирования.
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600°С. Выход ацетилена составляет 30-32%. Метод имеет преимущества – непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000°С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600°С. Образуется ацетилен. Метод характеризуется большей безопасностью и надежностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрен в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000-7000 кВт*ч) и высоких выходах ацетилена (87% в аргоновой плазме и 73% в водородной).
Карбидный метод
Этот способ известен с 19 века, но не потерял своего значения и до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500-3000°С:
Известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9%. Основным недостатком процесса является высокий расход электроэнергии: 10000-11000 кВт*ч на 1 тонну ацетилена.
Методы получения алкинов. Получение ацетилена
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана:
Крекинг природного газа (промышленный способ)
Электрокрекинг
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
Термоокислительный крекинг
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании:
Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия:
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке:
Получение Ацетилена
В лаборатории ацетилен получают действием воды на карбид кальция.
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана:
Крекинг природного газа (промышленный способ)
Электрокрекинг
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
Термоокислительный крекинг
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании:
Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия:
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке:
Получение Ацетилена
В лаборатории ацетилен получают действием воды на карбид кальция.
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Физические свойства
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии до 1,4 атм при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном.
Ацетилен обнаружен на Уране и Нептуне.
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород, состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода.
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород, сероводород и пр., которые придают ему резкий запах.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ. Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде. Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/Кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Читать также: Как сделать из ручного лобзика стационарный
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Жидкий
марка «А»марка «Б», I сорт
марка «Б», II сорт
Ацетилен — ненасыщенный углеводород C2H2. Имеет тройную связь между томами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2H2 есть на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 3300 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекулавысокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен можетполимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метаниз эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра иодновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидка),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Безопасность
Поскольку ацетилен растворим в воде и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры. Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например N2, метаном или пропаном. При длительном соприкосновении ацетилена с медью или серебром образуется взрывчатая ацетиленистая медь или ацетиленистое серебро, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов). Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест». ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), т.к. концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100%. Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Применение
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей, пластических масс, синтетических каучуков, ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода,
– как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды.
Безопасность
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Примечания
- ↑ 12
ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия - ↑
А.Л.Лапидус, И.А.Голубева, Ф.Г.Жагфаров. Газохимия. Учебное пособие. — Москва: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1. - ↑
Большая энциклопедия нефти и газа. Неприятный запах — ацетилен. Проверено 10 октября 2013. - ↑
Корольченко, Пожаровзрывоопасность веществ, 2004, с. 198. - ↑
Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72. - ↑
Ацетилен. Проверено 10 октября 2013. - ↑
В России разработали ракетный двигатель на аммиаке — Известия
Области применения ацетилена
Ацетилен – это горючий газ, который используется при газовой сварке. Нередко его используют для кислородной резки. Стоит отметить, что температура горения смеси кислорода и ацетилена может достигать 3300°С. Благодаря этому свойству вещество чаще других используется при сварке. Ацетиленом обычно заменяют природный газ и пропан-бутан. Вещество обеспечивает производительность и высокое качество сварки.
Снабжение постов газом для резки и сварки может осуществляться от ацетиленового генератора или же от баллонов с ацетиленом. Для хранения данного вещества обычно используют емкости белого цвета. Как правило, на них присутствует надпись «Ацетилен», нанесенная красной краской. Стоит учесть, что существует ГОСТ 5457-75. Согласно данному документу для обработки металлов применяется технический растворенный ацетилен марки Б или же вещество в газообразном виде.
Ссылки
- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
| Углеводороды | |
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Гептадекан • Октадекан • Нонадекан • Эйкозан • Докозан • Гектан |
| Алкены | Этилен • Пропен • Бутены • Пентены • Гексены • Гептены • Октен |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен • Циклобутадиен |
| Другие ненасыщеные | Винилацетилен • Диацетилен • Каротин |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан • Инден |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан • Инден |
| Полициклические | Нафталин • Антрацен • Бензантрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
ацетилен, ацетилен + вода, ацетилен википедия, ацетилен вікіпедія, ацетилен гарган авах, ацетилен донецк, ацетилен получение, ацетилен формула, ацетилен хлорирование, ацетиленовий генератор