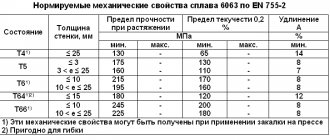
История открытия
Впервые на то, что в сплавах (сталях и чугунах) есть определенные (особые) точки, указал великий металлург и изобретатель — Дмитрий Константинович Чернов (1868 год). Именно он сделал важное открытие о полиморфных превращениях и является одним из создателей диаграммы состояния железо-углерод. По мнению Чернова, положение этих точек на диаграмме имеет прямую зависимость от процентного содержания углерода.
И что самое интересное, именно с момента этого открытия и начинает свою жизнь такая наука, как металлография.
Диаграмма сплавов железа с углеродом является результатом кропотливого труда ученных нескольких стран мира. Все буквенные обозначения главных точек и фаз в диаграмме являются интернациональными.
Диаграмма состояния [ править | править код ]
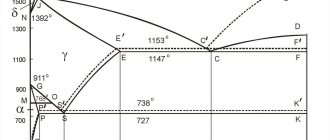
Железо образует с углеродом химическое соединение Fe3C цементит. Так как на практике применяют металлические сплавы на основе железа с содержанием углерода до 5 %, практически интересна часть диаграммы состояния от чистого железа до цементита . Поскольку цементит — метастабильная фаза, то и соответствующая диаграмма называется метастабильной
(сплошные линии на рисунке).
Для серых чугунов и графитизированных сталей рассматривают стабильную
часть диаграммы железо—графит (Fe—Гр), поскольку именно графит является в этом случае стабильной фазой. Цементит выделяется из расплава намного быстрее графита и во многих сталях и белых чугунах может существовать достаточно долго, несмотря на метастабильность. В серых чугунах графит существует обязательно.
На рисунке тонкими пунктирными линиями показаны линии стабильного равновесия (то есть с участием графита), там где они отличаются от линий метастабильного равновесия (с участием цементита), а соответствующие точки обозначены штрихом. Обозначения фаз и точек на этой диаграмме приведены согласно неофициальному международному соглашению.
Структуры на диаграмме железо-углерод
Напомним о 2 кристаллических формах железа:
- α-железо. Имеет объемноцентрированную кубическую (ОЦК) решетку;
- γ-желез. Имеет гранецентрированную кубическую (ГЦК) решетку.
Кристаллическая решетка железа Полиморфное превращение одной формы в другую при проведении термообработки сталей происходит при прохождении сплавами линии GSK.
Выделим 4 фазы в системе железо-углерод:
- Жидкая фаза. Концентрация углерода не ограничена;
- Феррит – это твёрдый раствор углерода в α-железе. Максимальная концентрация углерода – всего лишь 0,025% (точка P). При комнатной температуре – не выше 0,006%. Феррит мягок и пластичен.
- Аустенит – твёрдый раствор углерода в γ-железе. Максимальная концентрация углерода — 2,14 % (точка E). Аустенит имеет невысокую твёрдость, пластичен, не магнитится.
- Цементит — химическое соединение железа с углеродом (карбид железа, Fe3C). Концентрация углерода, соответственно, постоянная – 6,67 % углерода. Цементит очень твёрд, хрупок, непластичен.
В зависимости от условий образования выделяют:
- первичный цементит (образуется из жидкости);
- вторичный цементит (выделяется из аустенита вокруг его зерен);
- третичный цементит (выделяется из феррита по границам его зерен);
- эвтектоидный цементит (является составной частью перлита);
- эвтектический цементит (является составной частью ледебурита).
Необходимо так же выделить 2 структурные составляющие железоуглеродистых сплавов:
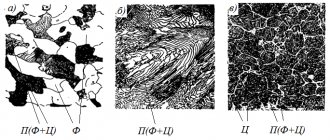
- Перлит (эвтектоид) – механическая смесь 2 фаз – пластинок/зерен феррита и цементита. Перлит образуется в результате перлитного превращения аустенита («свободного» или входящего в состав ледебурита) с концентрацией углерода 0,8% при прохождении ниже линии PSK:
А0,8→Ф0,025 + Ц6,67
Структура перлита. Ф — феррит, Ц — цементит
Железо при этом переходит из γ-формы в α-форму. Механические свойства сильно зависят от размера (дисперсности) частичек, из которых состоит данный перлит.
- Ледебурит (эвтектика) – механическая смесь 2 фаз – пластинок/зерен аустенита и цементита. Ледебурит образуется из жидкой фазы с концентрацией углерода 4,3% при прохождении ниже линии ECF:
Ж4,3→А2,14 + Ц6,67
Структура ледебурита. Ц — цементит, А — аустенит.
Повторяясь, напомним, что при прохождении сплавов ниже линии PSK (727°С) аустенит, входящий в состав ледебурита, претерпевает перлитное превращение, разделяясь на феррит и цементит. Ледебурит тверд и хрупок.
При комнатной температуре железоуглеродистые сплавы могут иметь различную структуру, а значит и свойства, хотя и состоят всегда всего из 2 фаз: феррита и цементита.
Компонентный состав
Диаграмма железо-углерод была разработана, чтобы показать микроструктурное состояние металла как функцию температуры и содержания углерода. Она показывает, что, в зависимости от интенсивности охлаждения стали, в ней могут возникать очень разные микроструктуры.
Когда металл расплавлен, то есть находится в жидком состоянии, решётчатые структуры отсутствуют. Атомы могут свободно перемещаться во всех направлениях. Чтобы достичь желаемых кристаллических структур, необходимо, чтобы металл медленно и полностью остыл при комнатной температуре. Промежуточные термические обработки положительно влияют на формирование кристаллических структур.
По вертикальной оси диаграммы железо-углерод располагается шкала температур в °C. Металл показан здесь от твердого до жидкого состояния. Например, чистое железо начинает плавиться при 1147°C. Температура устойчивого состояния расплава — 1536 °C.
По горизонтальной оси указывается процентное содержание углерода в металле.
Линии, которые соединяют характерные точки диаграммы, отмечают трансформацию металла. Они разделяют участки, где металл находится в в состоянии преобразования из твёрдого состояния в жидкое. Но одновременно диаграмма состояния «железо-углерод» определяет и реорганизацию атомов в кристаллической решётке.
Диаграмма показывает участки, в которых металл находится только в состоянии. расплава, феррита или аустенита. Остальные зоны характеризуются определённым сочетанием свойств. Это, например, расплав и аустенит, аустенит и феррит, феррит и перлит.
Обозначение точек пересечения заглавными буквами на линиях преобразования предназначено для лучшего понимания. Они указывают на переход в другое состояние или условие.
Диаграмма предполагает постоянное охлаждение металлов. Если металл медленно охлаждать, образуются крупные зёрна, если же металл остывает быстро, то размеры зёрен уменьшаются. Тип зерна металла определяет его прочностные свойства. Крупнозернистый материал имеет меньшую прочность, но его можно сделать более мелким и, следовательно, более прочным путём термической обработки или пластического деформирования (упрочнением). Самый высокий уровень прочности имеет именно мелкозернистый металл.
Выполним краткую характеристику основных химических компонентов диаграммы.
Железо
Железо образует кубическую пространственную решётку. Атомы железа расположены по углам этой решётки. Количество углерода, которое может быть растворено в железе, зависит от модификации железа, потому что разные формы кристаллической решетки железа (например, кубическая пространственно-центрированная и кубическая гранецентрированная) имеют межстраничные промежутки разного размера.
Второстепенную роль играет дельта-смешанный кристалл, который имеет объемно-центрированные атомы, но существует только в высоколегированных сталях. Эти кристаллы образуются в диапазоне температур от 1536 °C (точка плавления чистого железа) до 1392 °C.
Альфа-смешанный кристалл существует как объемно-центрированная кубическая решетка. Эти структуры образуются в чистом железе до температуры 911 °C.
В гамма смешанном кристалла атомы железа гранецентрированы, и это означает, что они расположены в середине каждой грани куба. Эти кристаллы образуются при температурах от 1392 °C до 911 °C в чистом железе.
Углерод
В низких концентрациях, углерод не образует твёрдого химического соединения с железом, но откладывается в промежутках кристаллической решетки железа.
Углерод в железе является примесью внедренияи может существовать в форме гранецентрированную или объемно-центрированной кубической решётки. Диаграмма состояния сплавов железо-углерод устанавливает области стабильного существования твёрдого раствора с α, γ и δ фазами железа.
Описанные выше кристаллические решётки имеют различную растворимость углерода в зависимости от температуры. Углерод осаждается в междуузельных пространствах кристаллической решётки, при этом гранецентрированная кубическая решетка, также называемая аустенитом, имеет растворимость не более чем в сто раз выше, чем кристаллы феррита.
Цементит
Цементит — метастабильная фаза сплава с фиксированным составом, имеющий химическую формулу Fe3C. При комнатной температуре цементит очень медленно разлагается на железо и углерод (графит).
Некоторые другие факторы (например, высокие температуры и добавление определенных легирующих элементов) могут влиять на это разложение, поскольку они способствуют образованию графита.
Цементит твёрдый и хрупкий, что делает его пригодным для упрочнения сталей (существует специальная технология химико-термической обработки стали, которая называется цементацией). Механические свойства цементита зависят от его микроструктуры, а также от условий связи с ферритом.
Жидкий раствор Fe-C на диаграмме обозначается выше линии L (ликвидус). Поскольку δ-феррит плавится при 1538 °C, очевидно, что температура плавления железа снижается с увеличением содержания углерода.
Перлит
Зёрна перлита включают в себя структурные объединения, где все образовавшиеся пластины между собой параллельны. При возрастании числа перлитных конкреций рост размеров пластин приостанавливается, а сами они могут изменить направление своего движения. С уменьшением температуры колонии перлита превращаются в шаровидные мелкозернистые образования.
Ледебурит в сталях
Ледебурит — один из основных структурных компонентов железоуглеродистых сплавов и является эвтектическую смесью аустенита и цементита, которая образуется при 1145°C и ниже (для чистых железоуглеродистых сплавов). Аустенит превращается в ферритно-цементитную смесь при температурах ниже 723°C. В сталях ледебурит, состоящий из аустенита и карбидов, образуется только при очень высоком содержании компонентов сплава и углерода (0,7…1,0%); такие стали (называются ледебуритовыми сталями.
Метастабильная нелегированная эвтектика ледебурита Fe – Fe3C классифицируется как квазирегулярная. Доказано, что после зарождения Fe3C рост пластин цементита происходит быстро, в результате на стыках образуется аустенит, и возникает взаимосвязь ориентации. Fe3C и аустенит также растут совместно и образуют стержневую структуру, которая располагается перпендикулярно пластинам цементита. Эти два режима роста образуют квазирегулярную структуру, но рост по краю происходит быстрее, чем по бокам, и доминирует в структуре. Эксперименты по направленной кристаллизации показали, что рабочая точка на кривой роста квазирегулярной структуры близка к точке экстремума. Такую квазирегулярную структуру можно модифицировать закалкой, но модификация примесей пока не исследовалась.
Структурная подложка сталей ледебуритного класса имеет доэвтектические компоненты, включающие перлит, ледебурит и шаровидный графит. Легированный слой состоит из дендритов и междендритов. В чугуне с шаровидным графитом конкреции графита постепенно растворяются в ванне расплава, и в то же время под действием гидродинамических сил и сил текучести перемещаются к поверхности.
Некоторые элементы диаграммы железо-углерод
Выделим несколько границ на диаграмме железо-углерод:
- линия ACD. Линия ликвидус. При охлаждении сплавов ниже нее начинается их кристаллизация;
- линия AECF. Линия солидус. При охлаждении сплавов ниже нее весь сплав переходит в твердое состояние;
- линия ECF. Иногда называется линией ледебуритного превращения. При охлаждении сплавов с содержанием углерода выше 2,14% ниже нее жидкая фаза превращается в ледебурит;
- линия PSK. Линия перлитного превращения. При охлаждении сплавов ниже нее аустенит превращается в перлит.
Отметим несколько важных точек на диаграмме:
- точка E. Точка максимального насыщения аустенита углеродом – 2,14%, при температуре 1147°С;
- точка P. Точка максимального насыщения феррита углеродом – 0,025%, при температуре 727°С;
- точка S. Точка «0,8% С-727°С» превращения аустенита с концентрацией углерода 0,8% в перлит (эвтектоид) той же средней концентрации;
- точка C. Точка «2,14 % С-1147°С» превращения жидкости с концентрацией углерода 2,14% в ледебурит (эвтектику) той же средней концентрации.
Часто значения температур, при которых происходят структурные изменения конкретного сплава обозначают буквами A:
- A1 – линия PSK;
- A2 – линия MO – точка Кюри, в которой происходит изменение магнитных свойств сплавов;
- A3 – температуры, соответствующие линии GS;
- Acm – температуры, соответствующие линии SE.
Поскольку температуры фазовых переходов при нагреве и охлаждении слегка отличаются, то часто вводят дополнительные буквенные обозначения:
- с – для температур фазовых переходов при нагреве;
- r – при охлаждении,
например, Ac1 или Ar1.
Применение диаграммы состояния железоуглеродистых сплавов
Диаграмму состояния сплавов системы железо—цементит применяют для определения режима термической обработки сплава, температуры нагрева металла под ковку и температурного предела ковки, а также температуры плавления, что необходимо для назначения режима заливки жидкого сплава в формы.
Термическая обработка производится путем нагрева металлических сплавов до определенных температур, выдержки при этих температурах и последующего быстрого или медленного охлаждения с целью изменения свойств сплава в желаемом направлении.
Термическая обработка железоуглеродистых сплавов имеет ряд разновидностей, основанных на том, что неустойчивая при низких температурах структура аустенита в зависимости от скорости охлаждения сплава превращается в структуры, обладающие различными свойствами. Продуктами распада аустенита являются мартенсит, троостит, сорбит и перлит.
Мартенсит — продукт закалки аустенита и его превращения в феррит без выделения углерода из раствора. Поэтому мартенсит — это сильно пересыщенное углеродом α-железо с кпженной кристаллической решеткой. Эго обусловливает высокую его твердость (НВ 600—700) и прочность, повышенную и ость и наличие внутренних напряжений. Эта структура образуется при больших скоростях охлаждения — закалки (180 ÷ сек для углеродистой стали). Мартенсит по своей природе неустойчив и при нагреве до температуры свыше 70° стремится перейти в другие структуры.
Трооститом называется механическая смесь феррита цементита очень высокой степени дисперсности. Твердость троостита НВ 350÷500. Эта структура образуется при скорости закалки углеродистой стали около 80°/сек. Игольчатый троостит иногда называют бейнитом.
Сорбит — это более грубая механическая смесь зерен феррита и цементита, однако достаточно дисперсная. Она с трудом различается под обычным микроскопом. Твердость сорбита 250÷350. Эта структура образуется при скоростях закалки углеродистой стали менее 50°/сек. По сравнению с трооститом copбит имеет более высокую вязкость, а по сравнению с перлитом — большую твердость.
Перлит представляет собой более или менее грубую механическую смесь феррита и цементита. Перлит образуется при малых Скоростях охлаждения стали, нагретой до аустенитного состояния.
Троостит, сорбит и перлит можно получить путем отпуска мартенсита при возрастающих температурах отпуска. В этом случае они имеют отличные, часто более высокие механические свойства, чем при охлаждении аустенита с разными скоростями.
Таким образом, путем изменения режима термической обработки можно получать различные физико-механические свойства и структуры стали. К операциям термической обработки относятся отжиг, нормализация, закалка и отпуск.
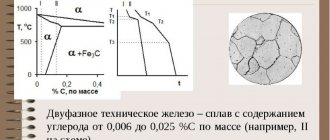
Отжиг — фазовая перекристаллизация — заключается в нагреве доэвтектоидной стали выше линии А3, а заэвтектоидной — выше линии Аст с последующим медленным охлаждением вместе с печью. Если нагреть сталь выше А1, но ниже, А3 (или Аст), то полной перекристаллизации не произойдет. Tal кая термическая обработка называется неполным отжигом. При отжиге состояние стали приближается к равновесному. Поэтому структура отожженной стали состоит либо из феррита и перлита (доэвтектоидные стали), либо из перлита и вторичного цементита (заэвтектоидные стали).
Температурные пределы полного отжига, неполного отжига, высокого отпуска и нормализации, нанесенные на участке диаграммы состояния железо — цементит
Отжиг снижает твердость и повышает вязкость стали, улучшает ее обрабатываемость, снимает внутренние напряжения, а также устраняет структурную неоднородность и стабилизирует физические свойства.
Нормализация отличается от отжига повышенной скоростью охлаждения (на спокойном или движущемся воздухе). Нормализацию применяют для размельчения зерна металла и повышения его прочности.
Закалкой называется нагрев стали выше критической точки А3 (рис. 9) с последующим быстрым охлаждением в воде, масле или других охлаждающих средах. Обычно цель закалки — получение мартенситной структуры, подвергаемой затем отпуску. Неполная закалка происходит в случае, если доэвтектоидная сталь была нагрета до температуры, лежащей выше точки Аи но ниже точки А3. Феррит, содержащийся в такой стали наряду с аустенитом, закалки естественно не принимает. Заэвтектоидные стали закаливают с температур выше А1, но ниже Асm, так как нецелеобразно растворять при нагреве твердые включения вторичного цементита.
Температурные пределы ковки и горячей штамповки, нанесенные на участке диаграммы состояния железо — цементит.
При отпуске сталь нагревают до температуры ниже А1, выдерживают при этой температуре и медленно охлаждают вместе с печью. Низкий отпуск (175—250°) служит для повышения язкости стали при сохранении высокого предела прочности и твердости, уменьшения внутренних напряжений и получения более устойчивых структур. Высокий отпуск (до 700°) применяют для повышения пластичности и обрабатываемости стали и снижена прочности и твердости.
Ковку, горячую штамповку и прокатку стали производят при сравнительно высоких температурах. Нагрев стали производят до температуры на 100—150° ниже линии солидуса.
Окончание обработки стали давлением должно происходить и температурах, близких к А3, для доэвтектоидной стали, мшчание процесса при слишком низких температурах ведет к рочечности структуры стали, к снижению ее пластичности, копчание процесса при слишком высоких температурах ведет росту зерна стали (перегрев) и повышению ее хрупкости. Перерой можно исправить термической обработкой (отжигом, нормализацией).
При нагреве стали до температуры, близкой к линии солидуса АЕ, происходит окисление металла вдоль границ зерен, рпультате чего связь между последними нарушается и механическая прочность катастрофически падает. Такое явление называют пережогом, причем его нельзя исправить какой-либо следующей термической обработкой.
Сталь
(польск. stal, от нем. Stahl), деформируемый (ковкий) сплав железа с углеродом (до 2%) и др. элементами. С. — важнейший продукт
чёрной металлургии
, являющийся материальной основой практически всех отраслей промышленности. Масштабы производства С. в значительной степени характеризуют технико-экономический уровень развития государства.
Историческая справка.
С. как материал, используемый человеком, имеет многовековую историю. Наиболее древний способ получения С. в тестообразном состоянии —
сыродутный процесс
, в основе которого лежало восстановление железа из руд древесным углём в горнах (позднее в небольших шахтных печах). Для получения литой С. древние мастера применяли
тигельную плавку
— расплавление мелких кусков С. и чугуна в огнеупорных тиглях. Тигельная С. характеризовалась весьма высоким качеством, но процесс был дорогим и малопроизводительным. Таким способом изготовляли, в частности,
булат
и его разновидность —
дамасскую сталь
. Тигельный процесс просуществовал до начала 20 в. и был полностью вытеснен электроплавкой. В 14 в. возник
кричный передел
, заключавшийся в рафинировании предварительно полученного
чугуна
в т. н. кричном горне (двухстадийный процесс с получением чугуна и последующим переделом его в С. является основой и современных схем производства С.). В конце 18 в. начало применяться
пудлингование
, при котором, как и при кричном переделе, исходным материалом был чугун, а продуктом — тестообразный металл (
крица
) качество металла при этом было выше, а сам процесс характеризовался более высокой производительностью. Пудлингование сыграло важную роль в развитии техники, однако обеспечить всё возраставшие потребности общества в С. не могло. Лишь с появлением во 2-й половине 19 в.
бессемеровского процесса
и мартеновского процесса (см.
Мартеновское производство
), а затем и
томасовского процесса
стало возможным массовое производство литой С. В конце 19 в. начала применяться выплавка С. в электрических печах (см.
Электросталеплавильное производство
). До середины 20 в. главенствующее положение среди способов производства С. занимал мартеновский процесс, на долю которого приходилось около 80% выплавляемой в мире С. В 50-х гг. был внедрён
кислородно-конвертерный процесс
, причём в последующие годы его роль резко возросла. Наряду с указанными способами массового производства С. развиваются более дорогие и менее производительные способы, позволяющие получать особо чистый металл высокого качества: вакуумная дуговая плавка (см.
Дуговая вакуумная печь
), вакуумная индукционная плавка,
электрошлаковый переплав
,
электроннолучевая плавка
, плазменная плавка (см.
Плазменная металлургия
).
Структура и свойства стали.
К С. как важнейшему материалу современной техники предъявляются разнообразные требования, что обусловливает большое число марок С., отличающихся по химическому составу, структуре, свойствам. Основной компонент С. — железо. Свойственный железу
полиморфизм
, т. е. способность кристаллической решётки менять своё строение при нагреве и охлаждении, присущ и С. Для чистого железа известны 2 кристаллические решётки — кубическая объёмноцентрированная (a-железо, при более высоких температурах d-железо) и кубическая гранецентрированная (g-железо). Температуры перехода одной модификации железа в другую (910 °С и 1400 °С) называются критическими точками. Углерод и др. компоненты и примеси С. меняют положение критических точек на температурной шкале. Взаимодействие углерода с модификациями железа приводит к образованию т. н.
твёрдых растворов
. Растворимость углерода в a-железе весьма мала; этот раствор называется
ферритом
. В g-железе, существующем при высоких температурах, растворяется практически весь углерод, содержащийся в С. (предел растворимости углерода в g-железе 2,01%); образующийся раствор называется
аустенитом
. Содержание углерода в С. всегда превышает его растворимость в a-железе; избыточный углерод образует с железом химическое соединение — карбид железа Fe3C, или
цементит
. Т. о., при комнатной температуре структура С. состоит из частиц феррита и цементита, присутствующих либо в виде отдельных включений (т. н. структурно-свободных феррита и цементита), либо в виде тонкой механической смеси, называемой
перлитом
. Общие сведения о температурных и концентрационных границах существования фаз (феррита, цементита, перлита и аустенита) даёт диаграмма состояния сплавов Fe — С (см.
Железоуглеродистые сплавы
).
Для феррита характерны относительно низкие прочность и твёрдость, но высокие пластичность и ударная вязкость. Цементит хрупок, но весьма твёрд и прочен. Перлит обладает ценным сочетанием прочности, твёрдости, пластичности и вязкости. Соотношение между этими фазами в структуре С. определяется главным образом содержанием в ней углерода; различные свойства этих фаз и обусловливают многообразие свойств С. Так, С., содержащая ~0,1% С (в её структуре преобладает феррит), характеризуется большой пластичностью; С. этого типа используется для изготовления тонких листов, из которых штампуют части автомобильных кузовов и др. деталей сложной формы. С., в которой содержится ~0,6% С, имеет обычно перлитную структуру; обладая повышенной твёрдостью и прочностью при достаточной пластичности и вязкости, такая С. служит, например, материалом для ж.-д. рельсов, колёс, осей. Если С. содержит около 1% С, в её структуре наряду с перлитом присутствуют частицы структурно-свободного цементита; эта С. в закалённом виде имеет высокую твёрдость и применяется для изготовления инструмента. Диапазон свойств С. расширяется с помощью легирования
, а также
термической обработки
,
химико-термической обработки
,
термомеханической обработки
металла. Так, при
закалке
С. образуется метастабильная фаза
мартенсит
— пересыщенный твёрдый раствор углерода в a-железе, характеризующийся высокой твёрдостью, но и большой хрупкостью; сочетая закалку с
отпуском
, можно придать С. требуемое сочетание твёрдости и пластичности.
Классификация сталей.
В современной металлургии С. выплавляют главным образом из чугуна и стального лома. По типу сталеплавильного агрегата (кислородный конвертер, мартеновская печь, электрическая дуговая печь) С. называется кислородно-конвертерной, мартеновской или электросталью. Кроме того, различают металл, выплавленный в основной или кислой (по характеру футеровки) печи; С. при этом называется соответственно основной или кислой (например, кислая мартеновская С.).
По химическому составу С. делятся на углеродистые и легированные. Углеродистая сталь
наряду с Fe и С содержит Mn (0,1—1,0%) и Si (до 0,4%), а также вредные примеси — S и Р; эти элементы попадают в С. в связи с технологией её изготовления (главным образом из шихтовых материалов). В зависимости от содержания С различают низкоуглеродистую (до 0,25% С), среднеуглеродистую (0,25—0,6% С) и высокоуглеродистую (более 0,6% С) С. В состав
легированных сталей
, помимо указанных компонентов, входят т. н.
легирующие элементы
(Cr, Ni, Mo, W, V, Ti, Nb, Zr, Со и др.), которые намеренно вводят в С. для улучшения её технологических и эксплуатационных характеристик или для придания ей особых свойств; легирующими элементами могут служить также Mn (при содержании более 1%) и Si (более 0,8%). По степени легирования (т. с. по суммарному содержанию легирующих элементов) различают низколегированные (менее 2,5%), среднелегированные (2,5—10%) и высоколегированные (более 10%) С. Легированные С. часто называются по преобладающим в ней компонентам (например, вольфрамовая, высокохромистая, хромомолибденовая, хромомарганцевоникелевая, хромоникелемолибденованадиевая).
По назначению С. делят на следующие основные группы: конструкционные, инструментальные и С. с особыми свойствами. Конструкционные стали
применяют для изготовления строительных конструкций, деталей машин и механизмов, судовых и вагонных корпусов, паровых котлов и др. изделий. Конструкционные С. могут быть как углеродистыми (до 0,7% С), так и легированными (основные легирующие элементы — Cr и Ni). Название конструкционной С. может отражать её непосредственное назначение (котельная, клапанная, рессорно-пружинная, судостроительная, орудийная, снарядная, броневая и т.д.).
Инструментальные стали
служат для изготовления резцов, фрез, штампов, калибров и др. режущего, ударно-штампового и мерительного инструмента. С. этой группы также могут быть углеродистыми (обычно 0,8—1,3% С) или легированными (главным образом Cr, Mn, Si, W, Mo, V). Среди инструментальных С. широкое распространение получила
быстрорежущая сталь
. К С. с особыми физическим и химическим свойствами относятся
электротехнические стали
,
нержавеющие стали
, кислотостойкие, окалиностойкие, жаропрочные, С. для постоянных магнитов и др. Для многих С. этой группы характерно низкое содержание углерода и высокая степень легирования.
По качеству С. обычно подразделяют на обыкновенные (рядовые), качественные, высококачественные и особо высококачественные. Различие между ними заключается в количестве вредных примесей (S и Р) и неметаллических включений
. Так, в некоторых С. обыкновенного качества допускается содержание S до 0,055—0,06% и Р до 0,05—0,07% (исключение составляет
автоматная сталь
, содержащая до 0,3% S и до 0,16% Р), в качественных — не более 0,035% каждого из этих элементов, в высококачественных — не более 0,025%, в особо высококачественных — менее 0,015% S. Сера снижает механические свойства С., является причиной
красноломкости
, т. е. хрупкости в горячем состоянии, фосфор усиливает
хладноломкость
— хрупкость при пониженных температурах.
По характеру застывания металла в изложнице различают спокойную, полуспокойную и кипящую С. Поведение металла при кристаллизации обусловлено степенью его раскисленности: чем полнее удалён из С. кислород, тем спокойнее протекает процесс затвердевания; при разливке малораскисленной С. в изложнице происходит бурное выделение пузырьков окиси углерода — С. как бы «кипит». Полуспокойная С. занимает промежуточное положение между спокойной и кипящей С. Каждый из этих видов металла имеет достоинства и недостатки; выбор технологии раскисления и разливки С. определяется её назначением и технико-экономическими показателями производства.
Маркировка сталей.
Единой мировой системы маркировки С. не существует. В СССР проведена большая работа по унификации обозначений различных марок С., что нашло отражение в государственных стандартах и технических условиях. Марки углеродистой С. обыкновенного качества обозначаются буквами Ст и номером (Ст0, Ст1, Ст2 и т.д.). Качественные углеродистые С. маркируются двузначными числами, показывающими среднее содержание С в сотых долях процента: 05, 08, 10, 25, 40 и т.д. Спокойную С. иногда дополнительно обозначают буквами сп, полуспокойную — пс, кипящую — кп (например, СтЗсп, Ст5пс, 08кп). Буква Г в марке С. указывает на повышенное содержание Mn (например, 14Г, 18Г). Автоматные С. маркируются буквой А (А12, А30 и т.д.), углеродистые инструментальные С. — буквой У (У8, У10, У12 и т.д. — здесь цифры означают содержание С. в десятых долях процента).
Обозначение марки легированной С. состоит из букв, указывающих, какие компоненты входят в её состав, и цифр, характеризующих их среднее содержание. В СССР приняты единые условные обозначения химического состава С.: алюминий — Ю, бор — Р, ванадий — Ф, вольфрам — В, кобальт — К, кремний — С, марганец — Г, медь — Д, молибден — М, никель — Н, ниобий — Б, титан — Т, углерод — У, фосфор — П, хром — Х, цирконий — Ц. Первые цифры марки обозначают среднее содержание С (в сотых долях процента для конструкционных С. и в десятых долях процента для инструментальных и нержавеющих С.); затем буквой указан легирующий элемент и цифрами, следующими за буквой,— его среднее содержание. Например, С. марки 3Х13 содержит 0,3% С и 13% Cr, С. марки 2X17H2 — 0,2% С, 17% Cr и 2% Ni. При содержании легирующего элемента менее 1,5% цифры за соответствующей буквой не ставятся: так, С. марки 12ХН3А содержит менее 1,5% Cr. Буква А в конце обозначения марки указывает на то, что С. является высококачественной, буква Ш — особо высококачественной. Обозначение марки некоторых легированных С. включает букву, указывающую на назначение С. (например, ШХ9 — шарикоподшипниковая С. с 0,9—1,2% Cr; Э3 — электротехническая С. с 3% Si). С., проходящие промышленные испытания, часто маркируют буквами ЭИ или ЭП (), ДИ () или ЗИ (Златоустовский завод) с соответствующим очередным номером (ЭИ268). См. также Металлургия
,
Сталеплавильное производство
.
Лит.:
Сталеплавильное производство. Справочник, под ред. А. М. Самарина, т. 1—2, М., 1964; Меськин В. C., Основы легирования стали, 2 изд., М., 1964; Гудремон Э., Специальные стали, пер. с нем., 2 изд., т. 1—2, М., 1966; Дреге В., Сталь как конструкционный материал, пер. с нем., М., 1967; Гуляев А. П., Чистая сталь, М., 1975.
С. И. Венецкий.
Сталь в искусстве.
В средние века славились арабское оружие и доспехи из С. с плоскими узорами и надписями, выполненными
гравированием
или
насечкой
. Эти приёмы декорировки оружейники средневековой Европы дополнили
чеканкой
, наводкой и полировкой. С 16 в. в отделке часов, научных приборов и инструментов появляется устойчивая к коррозии зеркальная полировка, использование которой послужило стимулом для выпуска бытовых изделий из С. В 18 — начале 19 вв. эстетические свойства С. наиболее ярко раскрылись в изделиях мастеров Тульского оружейного завода (мебель, зеркала, самовары, каминные экраны и т.п.). Как вид народного творчества известна с середины 19 в. златоустовская гравюра на С. В советском искусстве С. нашла применение в облицовке интерьеров, а также в скульптуре (В. И. Мухина, «Рабочий и колхозница», см.
илл.
).
Лит.:
Тульские «златокузнецы». [Альбом], Л., 1974.
Оглавление
Классификация железоуглеродистых сплавов
Различные комбинации этих элементов приводят к получению большого количества сплавов, которые можно разделить на три большие группы:
- Техническое железо.
- Стали.
- Чугуны.
Техническое железо
К техническому железу относят материалы, в которых содержится менее 0,02% углерода. К сталям относят, материалы, в которых углерод находится в пределах от 0,02 до 2,14%. И в группу чугунов входят материалы, количество углерода в которых превышает 2,14%.
Фазы диаграммы железо-углерод
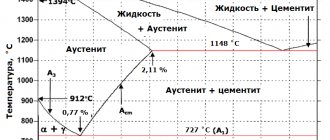
В системе железо — углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях[источник не указан 1441 день] с образованием однородной жидкой фазы.
Феррит — твёрдый раствор внедрения углерода в α-железе с объёмно-центрированной кубической решёткой.
Феррит имеет переменную, зависящую от температуры предельную растворимость углерода: минимальную — 0,006 % при комнатной температуре (точка Q), максимальную — 0,02 % при температуре 700 °C (точка P). Атомы углерода располагаются в центре грани или (что кристаллогеометрические эквивалентно) на середине рёбер куба, а также в дефектах решетки.
При температуре выше 1392 °C существует высокотемпературный феррит с предельной растворимостью углерода около 0,1 % при температуре около 1500 °C (точка H).
Свойства феррита близки к свойствам чистого железа. Он мягок (твёрдость по Бринеллю — 130 НВ) и пластичен, ферромагнитен (при отсутствии углерода) до точки Кюри — 770 °C.
Аустенит (γ) — твёрдый раствор внедрения углерода в γ-железе с гранецентрированной кубической решёткой.
Атомы углерода занимают место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в аустените — 2,14 % при температуре 1147 °C (точка Е). Аустенит имеет твёрдость 200—250 НВ, пластичен, парамагнитен. При растворении других элементов в аустените или в феррите изменяются свойства и температурные границы их существования [3] .
Цементит (Fe3C) — химическое соединение железа с углеродом (карбид железа), со сложной ромбической решёткой, содержит 6,67 % углерода. Он твёрдый (свыше 1000 HВ), и очень хрупкий. Цементит — метастабильная фаза и при длительном нагреве самопроизвольно разлагается с выделением графита.
В железоуглеродистых сплавах цементит как фаза может выделяться при различных условиях:
- цементит первичный (выделяется из жидкости),
- цементит вторичный (выделяется из аустенита),
- цементит третичный (из феррита),
- цементит эвтектический и
- эвтектоидный цементит.
Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зёрен аустенита (после эвтектоидного превращения они станут зёрнами перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зёрен [4] .
Эвтектический цементит наблюдается лишь в белых чугунах. Эвтектоидный цементит имеет пластинчатую форму и является составной частью перлита. Цементит может при специальном сфероидизируюшем отжиге или закалке с высоким отпуском выделяться в виде мелких сфер. Влияние на механические свойства сплавов оказывает форма, размер, количество и расположение включений цементита, что позволяет на практике для каждого конкретного применения сплава добиваться оптимального сочетания твёрдости, прочности, стойкости к хрупкому разрушению и т. п. [5]
Графит — фаза состоящая только из углерода со слоистой гексагональной решёткой. Плотность графита (2,3 г/см3) намного меньше плотности всех остальных фаз (около 7,5—7,8 г/см3) и это затрудняет и замедляет его образование, что и приводит к выделению цементита при более быстром охлаждении. Образование графита уменьшает усадку при кристаллизации, графит выполняет роль смазки при трении, уменьшая износ, способствует рассеянию энергии вибраций.
Графит имеет форму крупных крабовидных (изогнутых пластинчатых) включений (обычный серый чугун) или сфер (высокопрочный чугун).
Графит обязательно присутствует в серых чугунах и их разновидности — высокопрочных чугунах. Графит присутствует также и в некоторых марках стали — в так называемых графитизированных сталях.
Фазы в системе “железо-углерод”
Фазы — это физически однородные состояния сплава. Фаза имеет точный химический состав — определенное расположение и связь между атомами. Такая структура атомов придает разные свойства различным фазам.
Некоторые специальные сплавы могут существовать в нескольких фазах, что достигается нагревом металла до определенных температур и использованием разных процедур термообработки.
Жидкая
Существует при температуре, которая превышает 1457 oC. Фазовое превращение при этой температуре означает полное плавление, поэтому на диаграмме жидкая фаза всегда обозначается линией L.
Феррит
На диаграмме присутствует в трёх разных фазах:
- Фаза дельта-феррита (δ-Fe) представляет собой твердый раствор C в δ-Fe (ОЦК) в высокотемпературной области диаграммы. Раствор стабилен при температуре выше 1400 °C и плавится при температуре выше 1539 °C. Структурно подобен α-ферриту;
- Фаза гамма-феррита (γ-Fe) является твёрдым раствором C в γ-Fe, который называют аустенитом. Нестабилен ниже температуры 910 °C, превращаясь в δ-феррит при 1395 ° C.. Максимальная растворимость углерода составляет около 2,1% при 1147 °C. Аустенит мягок и пластичен, не обладает магнитными свойствами;
- Фаза альфа-феррита (α-Fe) представляет собой твердый раствор C в α-Fe с ОЦК-решёткой. Считается самой стабильной формой железа при комнатной температуре. Максимальная растворимость углерода составляет около 0,02% при 727 °C. Мягче аустенита, магнитен.
Аустенит в сталях
Аустенит всегда присутствует в нержавеющих сталях, которые содержат от 16 до 26 процентов хрома и до 35 процентов никеля. Аустенитные стали, помимо высокой коррозионной стойкостью, не закаливаются при термической обработке и немагнитны.
Формы существования цементита важны для определения коррозионной стойкости сталей. Доказано, что цементит (Fe3C) увеличивает скорость коррозии, причём этот эффект более выражен, когда он образует когерентную сеть на поверхности. В нормализованных сталях цементит образует когерентную сетку, а в отпущенном мартенсите — нет. Поэтому цементит влияет на скорость коррозии нормализованной, но не закалённой стали.
В целом скорость коррозии углеродистой стали снижается с увеличением содержания хрома из-за образования защитного оксида хрома. Однако, когда хром соединяется с углеродом с образованием карбида хрома, положительный эффект хрома теряется.
Влияние микроструктуры различных низколегированных сталей, показанное на этой модели, распространяется только на условия, в которых не образуются защитные плёнки. Более того, образование карбидной сетки на поверхности нормализованной стали — процесс, зависящий от времени.
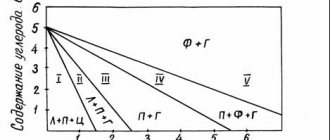
Чтение диаграммы железо-углерод
Состав сплава с данным исходным содержанием углерода при заданной температуре мы можем увидеть, двигаясь по вертикальной линии, соответствующей содержанию углерода в сплаве.
Рассмотрим, например, область AEC. С ней соседствуют области аустенита AESG и жидкой фазы. Сплавы в ней состоят из жидкой фазы и образующегося твердого аустенита. Как определить концентрацию углерода в разных фазах для данного сплава? Рассмотрим для примера сплав с исходной концентрацией углерода 2,5% при температуре 1250°С.
Проведем из этой точки графика «2,5% C – 1250°С» горизонтальную прямую. Пересечение этой прямой с линией AE, граничащей с областью аустенита, покажет концентрацию углерода в аустените при данной температуре (~1.5%).
Пересечение этой же горизонтальной прямой с линией AС, граничащей с областью жидкой фазы, покажет концентрацию углерода в жидкой фазе при данной температуре (~3.5%).
Именно таким образом мы можем определить концентрацию углерода в фазах любого сплава при заданной температуре:
- в жидкой фазе и аустените в области AEC;
- в жидкой фазе в области CDF (концентрация углерода в цементите, конечно, постоянна – 6,67%);
- в аустените в области SEFK;
- в феррите в области QPKL;
- в феррите и аустените в области GPS.
Как видим, при концентрации углерода выше 2,14% насыщение охлаждаемого расплава углеродом всегда стремится к 4,3% (по линиям AC и DC) по мере приближения к температуре 1147°С (уровень ECF). Далее происходит превращение жидкости в ледебурит (эвтектику). Естественно, с этим же средним содержанием углерода.
По мере приближения к температуре 727°С (уровень PSK) концентрация углерода в аустените («свободном» и/или входящем в состав ледебурита) стремится к 0,8% (по линиям GS и ES). Далее происходит превращение аустенита в перлит (эвтектоид). Перлит, конечно, имеет среднее содержанием углерода 0,8%.
Свойства технически чистого железа
Магнитные свойства железа при различных температурах:
- менее 768° С – ферромагнитно;
- более 768° С – парамагнитно.
А температурную точку 768° С называют точкой магнитного превращения, или точкой Кюри.
Свойства технически чистого железа:
- твердость – 80 НВ;
- временное сопротивление — 250 МПа;
- предел текучести – 120 МПа;
- относительное удлинение 50 %;
- относительное сужение – 80 %;
- высокий модуль упругости.
Компоненты в системе железо углерод
Аустенит
Атомы размещается в гранецентрированной ячейке. Твердость аустенита имеет твердость 200 … 250 единиц по Бринеллю. Кроме того у него хорошая пластичность и он отличается парамагнитностью.
Железо
Железо – это материал, относящийся к металлам. Его натуральный цвет – серебристо-серый. В чистом виде он очень пластичен. Его удельный вес составляет 7,86 г/куб. см. Температура плавления составляет 1539 °C. На практике чаще всего применяют техническое железо, в составе которого присутствуют следующие примеси – марганец, кремний и многие другие. Массовая доля примесей не превышает 0,1%.
Железо
У железа есть такое свойство как полиформизм. То есть, при одном и том же химическом составе, это вещество может иметь разную структуру кристаллической решетки и соответственно разные свойства. Модификации железа называют соответственно – Б, Г, Д. Все эти модификации существуют при разных условиях. Например, тип Б, может существовать только при температуре 911 °С. Тип Г может существовать в диапазоне от 911 до 1392 °С. Тип Д существует в диапазоне от 1392 до 1539 °С.
Каждый из типов обладает своей формой кристаллической решеткой, например, у типа Б решетка представляет собой куб, решетка типа Г имеет гранецентрированную кубическую форму. Решетка типа Д, имеет форму объемно центрированного куба.
Еще одно свойство состоит в том, что при температуре ниже 768 железо ферримагнитно, а при ее повышении это свойство теряется.
Точки полиморфной и магнитной трансформации называют критическими. На таблице они обозначены следующим образом – А2, А3, А4. Цифровые индексы показывают тип трансформации. Для более полного различия превращения железа из одного вида в другой к обозначению добавляют индексы с и r. Первый говорит о нагреве, второй об охлаждении.
Полиморфные модификации железа
При высоких параметрах пластичности, железо не обладает высокой твердостью, по шкале Бринелля она равна 80 единиц.
Железо имеет возможность образовывать твердые растворы. Их можно разделить на две группы – раствор замещения и внедрения. Первые состоят их железа и других металлов, вторые из железа и углерода, водорода и азота.
Углерод
Другой компонент системы – углерод. Это – неметалл и он обладает тремя модификациями в виде алмаза, графита и угля. Он плавится при 3500 °С.
Аллотропные модификации углерода
В сплаве железа, этот элемент находится в виде твердого раствора, его называют цементит или в виде графита. В таком виде он присутствует в сером чугуне. Графит, не отличается ни пластичностью, ни прочностью.
Цементит
Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Более точные исследования показали, что цементит может иметь переменную концентрацию углерода. Однако в дальнейшем, при разборе диаграммы состояния, сделаем допущение, что Fе3С имеет постоянный состав. Кристаллическая решетка цементита ромбическая, удельный вес 7,82 г/см3 (очень близок к удельному весу железа). При высоких температурах цементит диссоциирует, поэтому температура его плавления неясна и проставляется ориентировочно – 1260° С. Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 210° С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность.
Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: например, азотом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом.
Если графит является стабильной фазой, то цементит – это метастабильная фаза. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
Первичный цементит
Металлурги разделяют три типа этого вещества – первичный, вторичный, третичный.
Влияние химических элементов на свойства железоуглеродистых сплавов
Железоуглеродистый сплав кроме железа и углерода (постоянных компонентов) содержит полезные, вредные и постоянные (технологические) примеси, которые оказывают различные влияния на свойства конструкционных материалов.
Углерод в железоуглеродистом сплаве может находиться в виде карбида железа Fe3C (цементита) либо в виде графита.
Углерод является основным сплавляемым компонентом, который специально вводят для увеличения прочности, твердости и улучшения технологических и эксплуатационных свойств конструкционных материалов. Влияние углерода на свойства конструкционных материалов зависит от состояния или взаимодействия его с железом, т. е. от образования той или иной структуры железоуглеродистого сплава.
Если при взаимодействии углерода с железом образуется цементит, то сплав будет иметь высокие твердость, хрупкость и практически не будет поддаваться обработке резанием.
Если углерод, взаимодействуя с железом, образует структуры механических смесей (перлита или феррита), то сплав будет иметь высокие механические и технологические свойства.
Кремний и марганец в железоуглеродистых сплавах являются полезными примесями. Кремний в сплав попадает частично из руды, а основная масса — в процессе плавки при раскислении сплава.
Раскисление — это процесс удаления вредных включений оксида железа (FeO) путем введения раскислителей (марганца, кремния и различных ферросплавов). Раскислители, соединяясь с оксидом железа, образуют шлаки, которые подлежат удалению. Незначительная часть раскислителей остается в железоуглеродистом сплаве. Как правило, раскислению подлежит большинство сталей и чугунов.
Кремний полностью растворяется в основной структуре сплава с образованием твердого раствора, повышает предел текучести, уменьшает хрупкость. Высокое содержание кремния (1 … 2 %) придает стали упругость. Кроме того, кремний способствует преобразованию углерода из структуры цементита в свободный углерод в виде графита, уменьшая при этом твердость и хрупкость сплавов. Марганец попадает в сплав при переработке марганцевых руд, а также в процессе раскисления.
Марганец образует с железом твердый раствор, а также способствует образованию химического соединения, поэтому он повышает твердость, износостойкость, прочность. Высокое содержание марганца способствует образованию цементита, что приводит к повышению твердости и хрупкости сплава. Кроме того, марганец нейтрализует вредное влияние серы.
Сера и фосфор в железоуглеродистых сплавах являются вредными примесями.
Фосфор попадает в сплав из руды. Исходный чугун, как правило, имеет высокую массовую долю фосфора. Фосфор ограниченно растворяется в железе, а его избыточное содержание приводит к образованию фосфида железа — очень хрупкого соединения. Фосфор, растворяясь в железе, резко снижает его плотность и приводит к хрупкости в холодном состоянии. Это свойство называется хладноломкостью сплавов. Фосфор также приводит к повышению твердости и уменьшению прочности. Марганец, взаимодействуя с фосфором в процессе раскисления, удаляет его с образованием шлаков.
В отдельных случаях фосфор может быть полезен, так как улучшает обрабатываемость резанием, жидкотекучесть, а при наличии незначительного количества меди повышает коррозионную стойкость.
Сера попадает в сплав из руд, а также из топлива в процессе его горения. Не растворяясь в железе, сера образует с ним легкоплавкую и очень хрупкую механическую смесь (эвтектику) и делает сплав хрупким в районе температур красного каления (это свойство получило название красноломкости), поэтому железоуглеродистые сплавы с высоким содержанием серы не подвергаются горячей обработке давлением.
При высоком содержании в сплаве углерода наличие серы повышает его твердость и хрупкость, ухудшает литейные свойства, снижает жидкотекучесть, увеличивает усадку металла при охлаждении отливок и склонность к образованию микротрещин. Вредное влияние серы нейтрализуется марганцем. При введении в сплав незначительной массовой доли марганца образуется соединение с серой — сульфид марганца (MnS) вместо легкоплавкого сульфида железа (FeS). Сульфид марганца частично удаляется вместе со шлаком.
В железоуглеродистых сплавах могут находиться с очень низкой массовой долей различные газы: азот, водород и кислород. Эти химические элементы являются скрытыми примесями. Из-за сложности их химического анализа массовую долю этих элементов не определяют и в технических условиях не нормируют.
Кроме того, в незначительных количествах встречаются различные металлы (олово, цинк, сурьма, свинец, никель, медь, хром и др.) — случайные примеси. Эти группы металлов попадают как из руд, так и из перерабатываемого при металлургическом процессе стального лома.
Все перечисленные случайные примеси являются неизбежным следствием технологического процесса, т. е. специально не добавляются. В связи с этим получаемые стали с незначительной массовой долей никеля, меди, хрома и других металлов не рассматривают как легированные стали.
Кроме естественных, постоянных, скрытых и случайных химических элементов в железоуглеродистый сплав (особенно в сталь) вводят специальные химические элементы с целью изменения микроструктуры сплава, физико-химических и других свойств.
Специально вводимые в железоуглеродистый сплав химические элементы называют легирующими элементами, а сплавы, полученные на их основе, — легированными сплавами (сталями и чугунами).
В качестве легирующих элементов вводят алюминий, ванадий, вольфрам, молибден, медь, кобальт, кремний, никель, тантал, титан, хром и др.
Государственные стандарты строго регламентируют массовую долю полезных и вредных примесей в железоуглеродистых сплавах.
В сталях, как правило, содержание этих элементов, %, ограничивается следующими верхними пределами:
Марганец ………………………………………………………………………………… 0,8
Кремний ………………………………………………………………………………….. 0,5
Фосфор …………………………………………………………………………………… 0,05
Сера ………………………………………………………………………………………… 0,05
В чугунах по государственным стандартам допускается более высокая массовая доля, %, полезных и вредных примесей (в зависимости от групп и марок):
Марганец ……………………………………………………………………… 0,3 … 1,5
Кремний ………………………………………………………………………… 0,3 … 5,0
Фосфор …………………………………………………………………………. 0,20… 0,65
Сера ………………………………………………………………………………. 0,08 … 0,12
Другие структурные составляющие в системе «железо-углерод»
Кроме компонентов и фаз в системе сплавов «железо-углерод» присутствуют другие структурные составляющие — перлит и ледебурит.
Перлит
Перлит — эвтектоид, механическая смесь феррита и цементита, полученная в результате распада аустенита при охлаждении сплавов ниже 727° С. При медленном охлаждении перлит присутствует во всех сплавах с концентрацией углерода от 0,02 до 6,67%. Под микроскопом перлит может выглядеть либо как пластины, либо как зерна — зернистый перлит. Его вид, также как и механические свойства, зависит от скорости охлаждения сплава и вида его термической обработки.
Ледебурит в сталях
Ледебурит — эвтектика, механическая смесь аустенита и цементита, выделяющаяся из жидкости при охлаждении сплавов ниже 1147° С. Принципиальное отличие эвтектикой составляющей от эвтектоидной заключается в том, что первая выделяется из жидкости, а вторая из твердого раствора, в случае железоуглеродистых сплавов — из аустенита. Название данная структурная составляющая получила в честь имени немецкого ученого-металлурга Ледебура.
Цементит: формы существования
Так называют соединение углерода и железа. Это компонент чугуна и некоторых сталей. В него входит 6,67% углерода.
В его кристалл входит несколько октаэдров, они расположены друг по отношению к другу с некоторым углом. Внутри каждого из них расположен атом углерода. В результате такого построения получается следующая картина – один атом вступает в связь с несколькими атомами железа, а железо в свою очередь связано с тремя атомами этого элемента.
Кристаллическая решетка цементита
У этого вещества имеются все свойства, которые присущи металлам – электропроводность, своеобразным блеском, высокая теплопроводность. То есть, смесь железа и углерода, ведет себя как металл. Этот материал обладает определенной хрупкостью. Большая часть его свойств определена сложным строением кристаллической решетки.
Этот материал плавится при 1600 градусах Цельсия. Но на этот счет существует несколько мнений, одни исследователи считают, что его температура плавления лежит в диапазоне от 1200 до 1450, другие определяют, что верхний уровень равен 1300 °С.
Первичный цементит
Металлурги разделяют три типа этого вещества – первичный, вторичный, третичный.
Диаграмма железо-цементит
Первичный, получается из жидкости при закалке сплавов, которые содержат в себе 5,5% углерода. Первичный имеет форму в виде крупных пластин.
Вторичный
Этот элемент получается из аустенита при охлаждении последнего. На диаграмме этот процесс этот процесс можно видеть по диаграмме Fe – C. Цементит представлен в виде сетки, размещенной по границам зерен.
Третичный
Этот тип, является производным от феррита. Он имеет форму иголок.
В металлургии существуют и другие формы цементита, например, цементит Стеда и пр.
Другие структурные составляющие в системе железо углерод
Перлит
Перлит – это механическая смесь, которая состоит из феррита и цементита. Ледебурит представляет собой переменный раствор.
Перлит
При температуре от 1130 и до 723 °С в его состав входят аустенит и цементит. При более низких температурах он состоит из аустенит заменяет феррит.
Чугуны
Сплавы на диаграмме железо-углерод, которые содержат углерода более, чем 2,14 %, называются чугунами. Они обладают высокой хрупкостью. Поперечное сечение такого чугуна имеет светлый тон, а потому его называют белым чугуном.
На диаграмме это точка С, называемая эвтектикой, с соответствующим содержанием углерода 4,3 %. При кристаллизации образуется смесь, состоящая из аустенита и цементита, в совокупности называемая ледебуритом. Фазовый состав постоянен.
При концентрации углерода менее 4,3 % (доэвтектический чугун) при кристаллизации выделяется аустенит из раствора. Далее из него выделяется Ц2. А при 727° С аустенит превращается в перлит. Структурное состояние такого чугуна следующее: крупные участки перлита темного тона.
В заэвтектическом белом чугуне (углерода более 4,3%) при охлаждении структурирование происходит с образованием кристаллов Ц1. Далее превращения осуществляются уже в твердом состоянии. Структура представляет собой ледебурит, который является фоном для полей перлита темного тона. А крупные пласты – это Ц1.
Узловые критические точки
Диаграмма «железо-углерод» с пояснениями позволяет облегчить изучение кинематики формирования различных микроструктур. Фазовые диаграммы помогают металлургам понять, какие фазы являются термодинамически стабильными, метастабильными или нестабильными. Пользуясь ими, можно выбрать соответствующие элементы для легирования стали. Фазовые диаграммы показывают нам также, как решать такие проблемы, как межкристаллитная коррозия, горячая коррозия, водородное повреждение и т.п.
Характерной точкой на диаграмме является точка эвтектики — место, где встречаются несколько фаз. На диаграмме «железо-углерод» эвтектическая точка находится там, где пересекаются линии A1, A3 и ACM. Образование этих точек случайно.
В этих точках происходят эвтектические реакции, при которых жидкая фаза затвердевает и превращается в смесь двух твердых фаз. Это происходит при охлаждении жидкого сплава эвтектического состава до его эвтектической температуры.
Сплавы, образующиеся на этом этапе, известны как эвтектические сплавы. Слева от этой точки сплавы называются заэвтектическими, а справа – заэвтектическими.
Выводы
Достичь абсолютного равновесия, как физического, так и химического, невозможно, кроме как в специальных лабораторных условиях.
На практике равновесие может быть приближено к абсолютному, но при определенных условиях: достаточно медленного повышения или понижения температуры сплава, который будет длительно выдерживаться по времени.
Источники
- https://FB.ru/article/340918/diagramma-jeleza-ugleroda-diagramma-sostoyaniya-sistemyi-jelezo-uglerod
- https://PokVorota3.ru/prokat/zhelezo-uglerod-2.html
- https://intehstroy-spb.ru/spravochnik/diagramma-sostoyaniya-zhelezo-uglerod-2.html
- https://NiceSpb.ru/materialy/diagramma-zhelezo.html
- https://pressadv.ru/stali/zhelezo-uglerod.html
- https://wiki2.org/ru/%D0%94%D0%B8%D0%B0%D0%B3%D1%80%D0%B0%D0%BC%D0%BC%D0%B0_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F_%D1%81%D0%BF%D0%BB%D0%B0%D0%B2%D0%BE%D0%B2_%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%BE-%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
- https://generator98.ru/raboty-so-stalyu/tablica-zhelezo-uglerod.html