История открытия
Прежде чем говорить о производстве сплава нужно разобраться с тем, откуда появились его главные составляющие. По археологическим находкам историки установили, что впервые свинец появился 6 тыс. лет назад. Он содержался в серебряных рудах.
Благородный металл использовался для изготовления украшений, посуды, столовых приборов. Свинец считался отходом и поэтому не использовался. Однако постепенно люди заметили свойства этого материала. Сегодня он используется при производстве:
- сплавов;
- аккумуляторов;
- конструкций, защищающих от радиоактивного излучения;
- красящих составов, припоев для радиоэлектроники;
- защитной оболочки для проводов.
Этот материал применяют в автомобилестроении.
Олово появилось около 3500 лет назад. Изначально оно использовалось для изготовления столовых приборов. В современной промышленности этот материал используется для создания консервных банок. Началось это с 1810 года, когда люди научились хранить продукты с помощью металлических емкостей. Олово используется при изготовлении радиаторов для автомобилей, подшипников.
Олово часто применяется для изготовления деталей промышленного оборудования. Это связано с его повышенным показателем твердости, прочности. Соединения этого металла со свинцом используется при создании подшипников, так как смесь считается износоустойчивой.
Физические свойства свинца
Археологические артефакты свидетельствуют о том, что этот химический элемент был известен человеку более 6000 лет назад. Его открытие связано с присутствием металла в рудах, содержащих серебро. При их выплавке материал выбрасывался в отходы, но со временем из него начали делать различные изделия: фигурки, водопроводные трубы. В настоящее время свинец применяется:
- для производства аккумуляторов;
- в кабельной промышленности — для создания защитной бесшовной оболочки;
- для изготовления красок и припоев;
- при строительстве защитных сооружений — для источников радиационного загрязнения (саркофагов);
- для производства сплавов на его основе (баббитов);
- для изготовления типографских составов;
- в медицине.
Главным потребителем свинца является автомобильная промышленность, где широко применяются баббиты. Производство свинцовых стартерных аккумуляторов постоянно растет, в разработки вносятся усовершенствования.
В химической промышленности материал используют для покрытия стальных изделий: аппаратов, резервуаров, трубопроводов. Так как железо и свинец между собой не соединяются, то на изделия предварительно наносят тонкий слой расплавленного олова. Такой процесс обработки называется лужением.
В производстве применяется не только чистый свинец, но и его соединения. Например, оксид свинца используется при изготовлении стекла. Незначительная добавка соединения в материал при плавке стекла позволяет придать хрустальным изделиям прозрачность естественного минерала — горного хрусталя.
Состав и структура
Соединения часто содержат не только два основных компонента, но и легирующие добавки. Основной из них является сурьма. Соединением может содержать до 15% этого вещества. Другими легирующими добавками является серебро, кадмий висмут. Серебро, сурьма действуют одинаково. Их добавляют, когда нужно увеличить температуру плавления материала. Если нужно сделать смесь менее тугоплавкой, она насыщается висмутом, кадмием.
Когда нужно создать износоустойчивый материал, который будет выдерживать постоянное трение, смесь дополняется медью. Благодаря множеству легирующих добавок, которые можно использовать при производстве сплавов олово и свинца, соединения используют в разных направлениях промышленности.
Плавление сплава
Свойства и маркировка
Готовые сплавы на основе олова и свинца обладают рядом свойств, которые делают соединение уникальным:
- Температура плавления — до 500 градусов по Цельсию зависимо от процентного содержания легирующих добавок.
- Высокий показатель износоустойчивости.
- Стойкость к окислению выше, чем у чистых материалов.
Существует два вида соединений свинца: баббиты и припои. Первые обозначаются буквой «Б». Далее указываются буквы легирующих добавок, процентное содержание основного вещества, количество дополнительных компонентов.
Классификация
Особенно распространены сплавы олова и свинца, имеющие название баббиты. Их можно разделить на несколько групп:
- Оловянные — обозначаются как Б83, Б89. Содержат сурьму, свинец. Олово выступает основой. Применяется при изготовлении подшипников для промышленного оборудования. Однако основной металл считается дорогим, поэтому часто используются более дешёвые аналоги.
- Свинцовые — обозначаются как Б16. Сплавы на основе свинца считаются более выгодными аналогами оловянных соединений. Высокий показатель износоустойчивости позволяет изготавливать из них детали для станков, подвижных механизмов.
- Кальциевые — твердые частицы, которые входят в состав этого сплава, представляют собой соединение кальция, свинца. Олово выступает как дополнительный компонент.
Сферы применения
Оловянные сплавы раньше использовались для изготовления посуды, столовых приборов. Сейчас их гораздо чаще применяют для создания консервных банок. Из этого материла в соединении с другими компонентами изготавливают припои, которые бывают нескольких видов:
- Легкоплавкие — температура плавления не превышает 150 градусов по Цельсию.
- Среднеплавкие — становятся жидкими при нагревании от 200 до 500 градусов.
- Тугоплавкие — плавятся при температуре свыше 1100 градусов.
Ещё одна сфера применения сплавов — производство деталей, устойчивых к трению.
Оловянно-свинцовый припой
Технические параметры олова
Данный химический элемент известен более 3500 лет и изначально предназначался для изготовления столовых предметов. Современное потребление олова связано с консервной промышленностью.
Патент на способ хранения продуктов в жестяных банках принадлежит повару из Франции. С 1810 года человечество получило возможность долговременного хранения пищевых продуктов.
Олово является основным компонентом припоев, применяемых для пайки и лужения теплообменных аппаратов, радиаторов автомобильных двигателей, лужения медицинской и пищевой аппаратуры.
Материал используется для производства оловянной бронзы, обладающей отличными механическими, литейными, антикоррозионными свойствами. Такие сплавы применяются в деталях, предназначенных для эксплуатации в особых условиях и и при особой нагрузке.
Сплавом, обладающим низким коэффициентом трения, является баббит. Он содержит 83% олова, сурьму и медь. Его применяют в производстве подшипников. Благодаря устойчивому соединению сурьмы и меди сплав имеет высокую твердость.
Механизм работы подшипника и компоненты состава исключают возникновение механических повреждений на поверхности детали.
Олово обладает специфическими физическими свойствами:
- Его деформация сопровождается звуком, образованным в результате сдвига под воздействием силы.
- При температурах -39 °C и + 161°C олово превращается в порошок.
Истории известны случаи таких преобразований. Пуговицы, сделанные из чистого материала, на морозе теряли свою форму, а «оловянная чума» разрушала слитки металла.
Особенности производства и обработки
Расходное сырьё получается из руды. Например, чтобы получить 1 килограмм чистого материала, необходимо переработать 100 кг руды. Плавятся оба материала при низких температурах. Для изготовления сплава нужно учитывать следующие особенности:
- При изготовлении формы для отливки нужно использовать материал, который не подвержен смачиванию расплавленными расходными металлами.
- Форма должна выдерживать нагрев при температуре свыше 250 градусов.
- Расплавленные металлы быстро окисляются под воздействием окружающей среды. Твердый металл защищён от окисления.
Если речь идёт о изготовлении припоя, то к соединению добавляют сурьму. Некоторые мастера добавляют серебро. Он обладает следующими особенностями:
- Серебро защищает материал от образования ржавчины.
- Из-за добавления благородного металла повышается ценник на готовый припой, но расширяется его функциональность.
Есть припои с добавлением цинка. Однако они редко используются. Цинк активно реагирует на воздействие факторов окружающей среды. Он начинает разрушаться, что приводит к нарушению целостности изделия. Лучше использовать смесь сурьмы, олова и свинца. Таким припоем паяют радиодетали, контакты, провода. Изменяя компоненты, мастера добиваются от расходника нужных характеристик. Нельзя забывать про использование флюса.
Сплав олова со свинцом обладает особыми характеристиками. Они изменяются после добавки легирующих компонентов. Применяются готовые соединения для изготовления припоев, износоустойчивых деталей, посуды, столовых принадлежностей, консервных банок.
Металлы IV группы главной подгруппы (Ge, Sn, Pb)
Германий (Germanium)
Германий
Германий относится к числу элементов, которые сначала были предсказаны Д.И.Менделеевым и лишь затем открыты. Менделеев поместил элемент, названный им экасилицием, в подгруппу углерода.
В 1885 г. австрийский химик Карл Ауэр фон Вельсбах, изучая состав нового минерала серебра, обнаружил, что в нем содержится около 7% какого-то неизвестного элемента. Вскоре немецкому ученому К.А.Винклеру удалось выделить его в виде простого вещества. Он назвал элемент германием в честь своей родины.
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и ее концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 до простого вещества: GeO2 + 2H2 = Ge + 2H2O.
Германий – твердое хрупкое вещество серебристого цвета с металлическим блеском (tпл = 938оС ), со структурой алмаза и свойствами полупроводника. При комнатной температуре он устойчив к действию воздуха, кислорода, воды, соляной и разбавленной серной кислот. Азотная и концентрированная серная кислота окисляют его до диоксида GeO2, особенно при нагревании: Ge + 2H2SO4 = GeO2↓ + 2SO2↑ + 2H2O
Германий взаимодействует также со щелочами в присутствии перекиси водорода. При этом образуются соли германиевой кислоты – германаты, например:
Ge + 2NaOH + 2H2O2 = Na2GeO3 + 3H2O
Соединения германия (II) малоустойчивы. Гораздо более характерны для германия соединения, в которых степень его окисления равна +4.
Германий обладает полупроводниковыми свойствами и с этим связано его основное применение. В технике его используют как материал для диодов, транзисторов, фотоэлементов. На основе пластин из высокочистого германия изготовляют солнечные батареи – устройства, преобразующие световую энергию в электрическую.
Из соединений германия применяют, например, GeO2, который входит в состав стекол, обладающих высоким коэффициентом преломления и прозрачностью в инфракрасной части спектра.
Олово (Stannum)
Оловянные слитки
Олово наряду со свинцом, железом, золотом, ртутью, медью, серебром входит в число «семи металлов древности». Оно известно человечеству по крайней мере с середины III тысячелетия до н.э. Люди обнаружили, что добавка к меди 5-10% олова повышает ее прочность и несколько снижает температуру плавления: чистая медь плавится при 1083оС , а медь содержащая 10% олова, — при 1005оС .
В природе олово встречается в виде минерала касситерита SnO2, месторождения которого довольно редки: в древности его добывали лишь в Испании, на Кавказе и в Китае. Как свидетельствует гомеровский эпос, олово ценилось еще во времена Троянской войны. При прокаливании смеси касситерита с углем олово, благодаря низкой температуре плавления (232оС ), легко отделялось. Так получают его и в наши дни.
Олово использовали для производства бронзы. Позже, когда человечество освоило выплавку железа, для которой необходима более высокая температура – порядка 1400 орудия из бронзы утратили своё значение.
Олово – мягкий серебристо-белый металл, пластичный и ковкий. Отлитая из олова палочка сгибается с характерным хрустом, вызванным трением друг от друга отдельных кристаллов. Интересно, что ниже 13,2 устойчива другая модификация – серое олово, которое имеет структуру алмаза. Переход белого олова в серое при низкой температуре часто происходит спонтанно, хотя для проведения его в лабораторных условиях требуется ввести небольшую затравку серого олова. Этот переход называют «оловянной чумой»: металл рассыпается в серый порошок, утрачивая металлические свойства. «Оловянная чума» послужила причиной гибели в 1912 г. английской экспедиции под руководством Роберта Скотта, направленной к Южному полюсу: керосин путешественники хранили в сосудах, паянных оловом.
Касситерит
Сплавы олова с сурьмой и медью применяются для изготовления подшипников. Эти сплавы обладают высокими антифрикционными свойствами. Сплавы олова со свинцом – припои – широко применяются для пайки. В качестве легирующего компонента олово входит в некоторые сплавы меди.
На воздухе олово при комнатной температуре не окисляется, но нагретое выше температуры плавления постепенно превращается в диоксид олова SnO2.
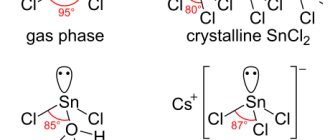
Вода на него не действует. Разбавленные соляная и серная кислоты действуют на него очень медленно, что объясняется большим перенапряжением водорода на этом металле. Концентрированные растворы этих кислот, особенно при нагревании, растворяют олово. При этом в соляной кислоте получается хлорид олова (II), а в серной – сульфат олова (IV):
Sn + 2HCl = SnCl2 + H2↑
Sn + 4H2SO4 = Sn(SO4)2 + 2SO2↑ + 4H2O
C азотной кислотой олово взаимодействует тем интенсивнее, чем выше концентрация кислоты и температура. В разбавленной кислоте образуется растворимый нитрат олова (II): 4Sn + 10HNO3 = 4Sn(NO3)2 + NH4NO3 + 3H2O
а в концентрированной – соединения олова (IV), главным образом нерастворимая β-оловянная кислота, состав которой приблизительно соответствует формуле H2SnO3:
Sn + 4HNO3 = H2SnO3↓ + 4NO2↑ + H2O
Концентрированные щелочи также растворяют олово. В этом случае получаются станниты – соли оловянистой кислоты H2SnO2:
Sn + 2NaOH = Na2SnO2 + H2↑
На воздухе олово покрывается тонкой оксидной пленкой, обладающей защитным действием. Поэтому в условиях несильного коррозионного воздействия оно является стойким металлом. Около 40% всего выплавляемого олова расходуется для покрытия им изделий из железа, соприкасающихся с продуктами питания, прежде всего – консервных банок. Это объясняется указанной химической активностью олова, а также тем, что оно легко наносится на железо и что продукты его коррозии безвредны. Олово образует устойчивые соединения, в которых имеет степень окисления +2 и +4.
Свинец (Plumbum)
Свинец
В Древнем Риме расплавленным свинцом заливали места стыков каменных блоков и труб водопровода (недаром в английском языке слово plumber – означает «водопроводчик»). Есть предположение, что именно поэтому многие историки отмечали частые отравления водой среди римлян.
Свинцовыми листами покрывали крыши зданий. Свинец шёл на изготовление печатей. Известны сосуды, отлитые из свинца. Плиний Старший в «Естественной истории» описывает и другие области применения этого металла: «В медицине свинец сам по себе применяется для стягивания рубцов, а привязанные в области чресел и почек пластинки из него своей более холодной природой сдерживают вожделения… Нерон… накладывая на грудь такие пластинки, громко произносил мелодекламации, показав этот способ для усиления голоса».
Свинцовые самородки крайне редко встречается в природе. Однако в виде соединения с серой – свинцового блеска, или галенита, PbS – свинец был известен уже древним мастерам. Красивые, блестящие кристаллы этого вещества, по-видимому привлекли внимание людей. Если положить их в костер, разведенный в неглубокой яме, на дно ее вскоре стечет расплавленный металл, ведь температура плавления свинца невысока – 327оС . Так его получали уже в III тысячелетии до н.э. Интересно, что и в наши дни в основе промышленного производства свинца лежат те же химические реакции – прокаливание свинцового блеска на воздухе: PbO + C = Pb + CO. Только древесный уголь заменен гораздо более дешевым коксом.
В Средние века считали, что свинец, символом которого была планета Сатурн, может превратиться в золото: ведь свинец очень тяжелый металл. Происхождение латинского названия элемента Plumbum до сих пор вызывает споры среди исследователей.
Галенит
Свинец – тяжелый и легкоплавкий металл синевато-серого цвета, плохо проводящий тепло и электричество. Он обладает удивительной мягкостью – его можно без особых усилий резать ножом. На воздухе свинец тускнеет, покрываясь тонкой плёнкой оксида PbO или основного карбоната Pb3(OH)2(CO3)2. Вода сама по себе не реагирует со свинцом, но в присутствии воздуха свинец постепенно разрушается водой с образованием гидроксида свинца (II):
2Pb + O2 + 2H2O = 2Pb(OH)2
Однако при соприкосновении с жесткой водой свинец покрывается защитной пленкой нерастворимых солей (главным образом сульфата и основного карбоната свинца), препятствующей дальнейшему действию воды и образованию гидроксида.
Разбавленные соляная и серная кислоты почти не действуют на свинец. Это связано со значительным перенапряжением выделения водорода на свинце, а также с малой растворимостью хлорида и сульфата свинца, закрывающих поверхность растворяющегося металла. В концентрированной серной кислоте, особенно при нагревании, свинец интенсивно растворяется с образованием растворимой кислой соли Pb(HSO4)2.
В азотной кислоте свинец растворяется легко, причем в кислоте невысокой концентрации быстрее, чем в концентрированной. Это объясняется тем, что растворимость продукта коррозии – нитрата свинца – падает с увеличением концентрации кислоты. Сравнительно легко свинец растворяется в уксусной кислоте, содержащей растворенный кислород.
2Pb + 4CH3COOH + O2 = 2Pb(CH3COO)2 + 2H2O
О способности свинца реагировать с уксусом знали уже в древности: из ацетата свинца в Древнем Риме делали свинцовые белила – смесь основных карбонатов свинца. Эту краску можно также получить взаимодействием свинцового сахара (ацетата свинца) с углекислым газом.
В щелочах свинец также растворяется, хотя и с небольшой скоростью; более интенсивно растворение идет в горячих разбавленных растворах. В результате растворения образуются гидроксоплюмбиты, например:
Pb + 4KOH + 2H2O = K4[Pb(OH)6] + H2↑
Все растворимые соединения свинца ядовиты.
Для свинца характерны степени окисления +2 и +4. Значительно более устойчивы и многочисленны со степенью окисления свинца +2.
Оксиды свинца
Сегодня около половины всего выплавляемого свинца используют в производстве аккумуляторов. Из свинца изготовляют оболочки кабелей, аппаратуру для химической промышленности, пули. Свинцовые экраны хорошо поглощают радиоактивное и рентгеновское излучения. Свинцовый сурик Pb3O4 необходим в производстве красок и эмалей. Оксид свинца (IV) PbO2, являющийся сильным окислителем, входит в состав спичек. В качестве инициирующего взрывчатого вещества используют азид свинца Pb(N3)2 – соль азидоводородной кислоты HN3.