История
В Старом Свете платина не была известна до середины XVI века, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. Первыми европейцами, познакомившимися с платиной в середине XVI века, были конкистадоры. Считается, что первым в литературе упомянул о платине Скалигер в опубликованной в 1557 году книге «Экзотерические упражнения в 15 книгах», где он, полемизируя с Кардано о понятии «металл», рассказал о некоем веществе из Гондураса, которое нельзя расплавить. Вероятно, этим веществом и была платина.
В 1735 году испанский король издаёт указ, повелевающий платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевалось тщательно отделять её от золота и топить под надзором королевских чиновников в глубоких местах речки Рио-дель-Пинто (приток Рио-Сан-Хуан (англ.)русск.), которую стали именовать Платино-дель-Пинто. А ту платину, которая уже привезена в Испанию, повелевалось всенародно и торжественно утопить в море. Королевское распоряжение было отменено через 40 лет, когда мадридские власти приказали доставлять платину в Испанию, чтобы самим фальсифицировать золотые и серебряные монеты. В 1820 году в Европу было доставлено от 3 до 7 тонн платины. Здесь с нею познакомились алхимики, считавшие самым тяжёлым металлом золото. Необычайно плотная платина оказалась тяжелее золота, поэтому алхимики посчитали её непригодным металлом и наделили адскими чертами. Некоторое применение платина нашла позже во Франции, когда из неё был изготовлен эталон метра, а позже эталон килограмма.
Согласно некоторым источникам, испанский математик и мореплаватель А. де Ульоа в 1744 году привёз образцы платины в Лондон, он поместил описание платины в своём отчёте о путешествии в Южную Америку, опубликованном в 1748 году. В 1789 А. Лавуазье включил платину в список простых веществ. Впервые в чистом виде из руд платина была получена английским химиком У. Волластоном в 1803 году.
В России ещё в 1819 году в россыпном золоте, добытом на Урале, был обнаружен «новый сибирский металл», который сначала называли белым золотом. Платина встречалась на Верх-Исетских, а затем и на Невьянских и Билимбаевских приисках. Богатые россыпи платины были открыты во второй половине 1824 года, а на следующий год в России началась её добыча. В 1826 году П. Г. Соболевский и В. В. Любарский изобрели метод выработки ковкой платины с помощью прессования и последующей выдержки в раскалённом добела состоянии.
Платина для человека
В сферу применения драгоценного металла входят нефтеперерабатывающая промышленность. Тут не обойтись без катализаторов, содержащих платину. Сюда уходит львиная доля (около половины добываемого благородного металла). Химическая промышленность использует благородный металл в производстве азотной кислоты.
Рекомендуем: УРАН — металл для мира и войны
Платина незаменима в радиотехнике, электротехнике, телемеханике, точном приборостроении.
Используют «серебришко» в медицине. Здесь из сплавов платины делают хирургические инструменты. Существуют методики лечения онкологических заболеваний с помощью цис-изомеров, производных двухвалентной платины.
Активность партии зеленых привела к росту потребления «королевы металлов» в автомобилестроении. Ужесточение норм по вредным выбросам в атмосферу привело к оснащению автомобилей автокатализаторами.
Из сплава платины с иридием изготовлен российский эталон килограмма.
Познавательно: в полиции и казино используют зеркала с платиновым покрытием. С освещенной стороны оно работает, как заурядное зеркало, с теневой — прозрачно, как стекло.
Нахождение в природе
Изотопы
Природная платина встречается в виде смеси из шести изотопов: 190Pt (0,014 %), 192Pt (0,782 %), 194Pt (32,967 %), 195Pt (33,832 %), 196Pt (25,242 %), 198Pt (7,163 %). Один из них слабо радиоактивен (190Pt, альфа-распад в 186Os, период полураспада 6,5⋅1011 лет). Предсказывается существование очень слабой радиоактивности ещё двух природных изотопов платины: альфа-распад 192Pt→188Os и двойной бета-распад 198Pt→198Hg, однако пока экспериментально эти распады не зарегистрированы; установлено лишь, что периоды полураспада превышают соответственно 4,7×1016 лет и 3,2×1014 лет.
Месторождения
Самородок платины, месторождение Кондёр
Платина является одним из самых редких металлов: её среднее содержание в земной коре (кларк) составляет 5⋅10−7 % по массе. Даже так называемая самородная платина является сплавом, содержащим от 75 до 92 процентов платины, до 20 процентов железа, а также иридий, палладий, родий, осмий, реже медь и никель.
Основная часть месторождений платины (более 90 %) заключена в недрах пяти стран. К этим странам относятся ЮАР (Бушвелдский комплекс), США, Россия, Зимбабве, Китай.
В России основными месторождениями металлов платиновой группы являются: Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые в Красноярском крае в районе Норильска (более 99 % разведанных и более 94 % оцененных российских запасов), Фёдорова Тундра (участок Большой Ихтегипахк) сульфидно-медно-никелевое в Мурманской области, а также россыпные Кондёр в Хабаровском крае, Левтыринываям в Камчатском крае, реки Лобва и Выйско-Исовское в Свердловской области. Крупнейшим платиновым самородком, найденным в России, является «Уральский гигант» массой 7860,5 г, обнаруженный в 1904 г. на Исовском прииске; в настоящее время хранится в Алмазном фонде.
Плотности астрономических объектов [ править | править код ]
- Средние плотности небесных тел Солнечной системы см. на врезке.
- Межпланетная среда в Солнечной системе достаточно неоднородна и может меняться во времени, её плотность в окрестностях Земли
10 −21 ÷10 −20 кг/м³. Плотность межзвёздной среды
10 −23 ÷10 −21 кг/м³.
- Плотность межгалактической среды 2×10 −34 ÷5×10 −34 кг/м³.
- Средняя плотность красных гигантов на много порядков меньше из-за того, что их радиус в сотни раз больше, чем у Солнца.
- Плотность белых карликов 10 8 ÷10 12 кг/м³
- Плотность нейтронных звёзд имеет порядок 10 17 ÷10 18 кг/м³.
- Средняя (по объёму под горизонтом событий) плотность чёрной дыры зависит от её массы и выражается формулой:
ρ = 3 c 6 32 π M 2 G 3 . ho =<3,c^<6>><32pi M^<2>G^<3>>>.>Средняя плотность падает обратно пропорционально квадрату массы чёрной дыры (ρ
M −2 ). Так, если чёрная дыра с массой порядка солнечной обладает плотностью около 10 19 кг/м³, превышающей ядерную плотность (2×10 17 кг/м³), то сверхмассивная чёрная дыра с массой в 10 9 солнечных масс (существование таких чёрных дыр предполагается в квазарах) обладает средней плотностью около 20 кг/м³, что существенно меньше плотности воды (1000 кг/м³).
Читать также: Дрель не набирает обороты
Получение
Самородную платину добывают на приисках (см. подробнее в статье Благородные металлы), менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 году английским ученым У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir3+ и Pd2+. Последующим добавлением хлорида аммония выделяют гексахлороплатинат (IV) аммония (NH4)2PtCl6. Высушенный осадок прокаливают при 800—1000 °C:
3(NH4)2[PtCl6] →T 2N2↑ + 2NH3↑ + 18HCl + 3Pt
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
Плотности некоторых жидкостей [ править | править код ]
Плотность жидкостей, кг/м³
| Бензин | 710 | Молоко | 1040 |
| Вода (4 °C) | 1000 | Ртуть (0 °C) | 13600 |
| Керосин | 820 | Диэтиловый эфир | 714 |
| Глицерин | 1260 | Этанол | 789 |
| Морская вода | 1030 | Скипидар | 860 |
| Масло оливковое | 920 | Ацетон | 792 |
| Масло моторное | 910 | Серная кислота | 1835 |
| Нефть | 550—1050 | Жидкий водород (−253 °C) | 70 |
Физические свойства
Серовато-белый пластичный металл, температуры плавления и кипения — 2041,4 K (1768,3 °C) и 4098 K (3825 °C) соответственно, удельное электрическое сопротивление — 0,098 мкОм·м (при 0 °С). Платина — один из самых тяжёлых (плотность 21,09—21,45 г/см³; атомная плотность 6,62⋅1022 ат/см³) металлов. Твёрдость по Бринеллю — 50 кгс/мм2 (по Моосу 3,5).
Кристаллическая решётка кубическая гранецентрированная, а
= 0,392 нм,
Z
= 4, пространственная группа
Fm
3
m
.
Платина устойчива к вакууму и может применяться в космической технике.
Зависимость плотности от температуры [ править | править код ]
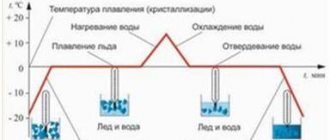
Как правило, при уменьшении температуры плотность увеличивается, хотя встречаются вещества, чья плотность в определённом диапазоне температур ведёт себя иначе, например, вода, бронза и чугун. Так, плотность воды имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры относительно этого значения.
При изменении агрегатного состояния плотность вещества меняется скачкообразно: плотность растёт при переходе из газообразного состояния в жидкое и при затвердевании жидкости. Вода, кремний, висмут и некоторые другие вещества являются исключениями из данного правила, так как их плотность при затвердевании уменьшается.
Химические свойства
Растворение платины в горячей царской водке
По химическим свойствам платина похожа на палладий, но проявляет бо́льшую химическую устойчивость. При комнатной температуре реагирует с царской водкой:
3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO↑ + 8H2O
Платина медленно растворяется в горячей концентрированной серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов):
Pt + 2Cl2 + 2NaCl → Na2[PtCl6]
При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объём поглощаемого водорода и способность его отдавать при нагревании у платины меньше.
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: чёрный PtO, коричневый PtO2, красновато-коричневый PtO3, а также Pt2O3 и смешанный Pt3O4, в котором платина проявляет степени окисления II и IV.
Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлороплатинатов, например:
Na2[PtCl4] + 2NaOH → 4NaCl + Pt(OH)2↓ Na2[PtCl6] + 4NaOH → 6NaCl + Pt(OH)4↓
Эти гидроксиды проявляют амфотерные свойства:
Pt(OH)2 + 2NaOH → Na2[Pt(OH)4] Pt(OH)2 + 4HBr → H2[PtBr4] + 2H2O Pt(OH)4 + 2NaOH → Na2[Pt(OH)6] Pt(OH)4 + 6HBr → H2[PtBr6] + 4H2O
Гексафторид платины PtF6 является одним из сильнейших окислителей среди всех известных химических соединений, способный окислить молекулы кислорода и ксенона:
O2 + PtF6 → O2 + [PtF6]−
Соединение O2+[PtF6]− (гексафтороплатинат(V) диоксигенила) летуче и разлагается водой на фтороплатинат(IV), небольшое количество гидратированного диоксида платины и кислород с примесью озона.
С помощью гексафторида платины, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона Xe[PtF6].
C обнаруженного Н. Бартлеттом взаимодействия между Хе и PtF6, приводящего к образованию Xe[PtF6], началась химия инертных газов. PtF6 получают фторированием платины при 1000 °C под давлением.
Фторирование платины при нормальным давлении и температуре 350—400 °C даёт фторид платины(IV):
Pt + 2F2 → PtF4
Фториды платины гигроскопичны и разлагаются водой.
Тетрахлорид платины с водой образует гидраты PtCl4·n
H2O, где
n
= 1, 4, 5 и 7. Растворением PtCl4 в соляной кислоте получают платинохлористоводородные кислоты H[PtCl5] и H2[PtCl6].
Синтезированы такие галогениды платины, как PtBr4, PtCl2, PtCl2·2PtCl3, PtBr2 и PtI2.
Для платины характерно образование комплексных соединений состава [PtX4]2- и [PtX6]2-. Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
Реакционная способность
Монета 3 рубля, 1834
Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее активно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
В своих соединениях платина проявляет почти все степени окисления от 0 до +6, из которых наиболее устойчивы +2 и +4. Для платины характерно образование многочисленных комплексных соединений, которых известно много сотен. Многие из них носят имена изучавших их химиков (соли Косса, Магнуса, Пейроне, Цейзе, Чугаева и т. д.). Большой вклад в изучение таких соединений внес русский химик Л. А. Чугаев (1873−1922), первый директор созданного в 1918 году Института по изучению платины.
Катализатор
Платина, особенно в мелкодисперсном состоянии, является очень активным катализатором многих химических реакций, в том числе используемых в промышленных масштабах. Например, платина катализирует реакцию присоединения водорода к ароматическим соединениям даже при комнатной температуре и атмосферном давлении водорода. Ещё в 1821 немецкий химик И. В. Дёберейнер обнаружил, что платиновая чернь способствует протеканию ряда химических реакций; при этом сама платина не претерпевала изменений. Так, платиновая чернь окисляла пары винного спирта (этанола) до уксусной кислоты уже при обычной температуре. Через два года Дёберейнер открыл способность губчатой платины при комнатной температуре воспламенять водород. Если смесь водорода и кислорода (гремучий газ) ввести в соприкосновение с платиновой чернью или с губчатой платиной, то сначала идет сравнительно спокойная реакция горения. Но так как эта реакция сопровождается выделением большого количества теплоты, платиновая губка раскаляется, и гремучий газ взрывается. На основании своего открытия Дёберейнер сконструировал «водородное огниво» — прибор, широко применявшийся для получения огня до изобретения спичек.
Плотности некоторых газов [ править | править код ]
Плотность газов, кг/м³ при НУ.
| Азот | 1,250 | Кислород | 1,429 |
| Аммиак | 0,771 | Криптон | 3,743 |
| Аргон | 1,784 | Ксенон | 5,851 |
| Водород | 0,090 | Метан | 0,717 |
| Водяной пар (100 °C) | 0,598 | Неон | 0,900 |
| Воздух | 1,293 | Радон | 9,81 |
| Гексафторид вольфрама | 12,9 | Углекислый газ | 1,977 |
| Гелий | 0,178 | Хлор | 3,164 |
| Дициан | 2,38 | Этилен | 1,260 |
Для вычисления плотности произвольного идеального газа, находящегося в произвольных условиях, можно использовать формулу, выводящуюся из уравнения состояния идеального газа: [7]
ρ = p M R T ho =>> ,
Плотность некоторых пород древесины [ править | править код ]
Плотность древесины, г/см³
| Бальса | 0,15 | Пихта сибирская | 0,39 |
| Секвойя вечнозелёная | 0,41 | Ель | 0,45 |
| Ива | 0,46 | Ольха | 0,49 |
| Осина | 0,51 | Сосна | 0,52 |
| Липа | 0,53 | Конский каштан | 0,56 |
| Каштан съедобный | 0,59 | Кипарис | 0,60 |
| Черёмуха | 0,61 | Лещина | 0,63 |
| Грецкий орех | 0,64 | Берёза | 0,65 |
| Вишня | 0,66 | Вяз гладкий | 0,66 |
| Лиственница | 0,66 | Клён полевой | 0,67 |
| Тиковое дерево | 0,67 | Бук | 0,68 |
| Груша | 0,69 | Дуб | 0,69 |
| Свитения (Махагони) | 0,70 | Платан | 0,70 |
| Жостер (крушина) | 0,71 | Тис | 0,75 |
| Ясень | 0,75 | Слива | 0,80 |
| Сирень | 0,80 | Боярышник | 0,80 |
| Пекан (кария) | 0,83 | Сандаловое дерево | 0,90 |
| Самшит | 0,96 | Эбеновое дерево | 1,08 |
| Квебрахо | 1,21 | Бакаут | 1,28 |
| Пробка | 0,20 |
Перевозки изделий из металлов
В системе грузоперевозок задействовано такое понятие, как «объёмный вес». Если масса предмета в одном кубическом метре 167 кг, то такой вес считается физическим, а если меньше — объёмным. Например, масса куба стали углеродистой — 7750 кг. Другими словами, объёмный вес стали 7750 кг. Эти расчёты нужны, чтобы определить, какой объем займёт перевозимый груз.
Однако в зависимости от того, какие металлические изделия перевозятся, объем будет меняться. Предположим, что есть несколько различных метизов одной и той же марки стали. По идее, они обладают одинаковой плотностью. Однако слитки, крупносортные изделия и бунты проволоки обладают различным объёмом, а следовательно, при их перевозке займут больше или меньше места на транспорте. Таким образом, они обладают разным объёмным весом. При любых условиях кубометр стали больше 167 кг, следовательно, его не назовёшь объёмным.
Что такое удельный вес
Удельным весом называют плотность, умноженную на ускорение свободного падения (силу тяжести) или отношение веса тела к его объёму. Путать его с плотностью недопустимо. Однако часто это происходит из-за смешения понятий массы и веса. Вес тела, а следовательно и удельный вес, изменяется в зависимости от силы тяжести. Он не является постоянной величиной. В зависимости от места, где находится предмет, он имеет разные значения. Эта физическая величина будет разной даже в разных точках Земли. Ускорение свободного падения на экваторе больше, чем на полюсах. Масса и плотность постоянны.
К примеру, можно вычислить удельный вес серебра. На Земле эта величина будет составлять 10500 кг/м³ (плотность чистого металла). Умножив на 9,81м/с 2 (сила тяжести), можно получить 103005 Н/м³. А на Луне 10500 кг/м³ умножается на 1,62м/с 2 (сила тяжести на Луне). Результат уже другой — 17,01Н/м³. В кабине корабля, вращающегося вокруг Земли — невесомость, ускорение равно нулю. Следовательно, и вес любого материала здесь ноль.
Все значения будут разными. Самое большое значение будет в первом случае, потому что на Земле ускорение свободного падения имеет самое большое значение. В невесомости вещь не весит ничего. Плотность одного и того же материала в любом месте будет одинаковой. Она является константой.
Для того, чтобы составить таблицы удельного веса металлов на различных планетах (или в других условиях), необходимо знать ускорение свободного падения и плотность.