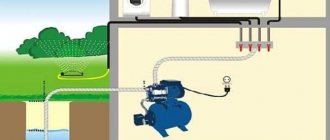
Физические свойства
В условиях комнатной температуры и без применения давления все вещества обладают твердым состоянием. Но есть галлий, он уже при 30 градусах тепла начинает деформироваться, тает в руках. Можно отметить характеристики:
- Высокая пластичность. Хрупкие только марганец, олово и цинк.
- Могут быть легкие и тяжелые. Сравни алюминий с осмием.
- Температура плавления очень большая. Есть и исключения, например, ртуть, именно по этой причине ее используют в классических термометрах.
- Цвет – серый, серебристый, голубоватый. Редкими являются цветные изделия, например, желтые или красные.
- Увеличенная проводимость тепла и электричества, особенно у меди, поэтому имеют популярность медные провода.
Железо сталь и прочие металлы
Железо и сталь — важнейшие металлы. Сталь получают из железа. Из нее делают множество предметов — от нефтяных вышек до канцелярских скрепок.
Наряду с 80 чистыми металлами людям известно немало сплавов — смесей металлов, качества которых отличаются от качеств чистых металлов. Башенные краны, мосты, другие сооружения делают из стали, содержащей до 0,2% углерода.
Углерод делает сталь прочнее, причем она сохраняет ковкость. Сталь покрывают краской для защиты от коррозии.
Железо и сталь
Железо — это элемент. Его добывают из руды — соединения железа с кислородом. Большая часть добытого железа идет на производство стали, сплава железа с углеродом. Наиболее распространенные железные руды: магнетит(вверху) и гематит(внизу). Железо добывается из руды в доменных печах.
Этот процесс называется плавкой. В печи через слой железной руды, известняка и кокса продувают очень горячий воздух. Кокс представляет собой почти чистый углерод, его получают нагреванием угля.
Углерод кокса соединяется с кислородом, образуя моноксид углерода, который затем «вытягивает» кислород из руды, оставляя чистое железо, и образует диоксид углерода. Это пример реакций восстановления. Руда, кокс и известняк поступают в печь. Известняк реагирует с имеющимися в руде примесями, образуя шлак.
Внутри печи раскаленный воздух реагирует с углеродом. Образуется моноксид углерода. При этом температура в печи повышается до 2000°С. Затем оксид углерода реагирует с кислородом руды, восстанавливая ее до железа. Расплавленный шлак вытекает из нижней части печи. Его используют в строительстве дорог.
В конце расплавленное железо выводится наружу. Доменная печь непрерывно функционирует 10 лет, пока её стенки не начнут разрушаться. Высота доменной печи 30 метров, толщина её стен 3 метра.
Железо, получаемое из руды, содержит углерод (около 4%) и другие примеси, в частности серу. Примеси делают железо хрупким, поэтому большую его часть перерабатывают в сталь. При этом из железа удаляются примеси. В стальных скрепках около 0,08% углерода.
Инструменты делают из стали, содержащей хром, ванадий и до 1% углерода. Сталь получают при воздействии на расплавленное железо кислорода. Часто в железо добавляют небольшое количество стального лома. Кислород реагирует с углеродом, содержащимся в железе, при этом образуется моноксид углерода, используемый как топливо.
После очистки в стали остается не более 0.04% углерода; его количество зависит от марки стали. Сталь получают также путем переплавки стального лома в дуговой электропечи. Для получения стали расплавленное железо и стальной лом заливают в печь, называемую
конвертером.
В конвертер под высоким давлением закачивается почти чистый кислород. При его реакции с углеродом получается моноксид углерода (см. так же статью «Химические реакции«). Другой способ получения стали — переплавка стального лома в дуговой электропечи. Мощный электрический ток (см.
статью «Электричество«) расплавляет лом. Расплавленный шлак вытекает из нижней части печи. Его используют в строительстве дорог.
Сплавы
Сплавом называется смесь двух или более металлов или металла и иного вещества. Так, латунь — это сплав меди и цинка. Латунь прочнее меди, ее легко обрабатывать, и она не подвержена коррозии. В чистых металлах атомы «упакованы» в тесные ряды (рис.
слева). Ряды могут скользить относительно друг друга, что делает металл мягким. При резких сдвигах рядов металл ломается. В сплаве другие атомы укрепляют металл (см. рис. справа), т.к. сдвиг рядов уже невозможен. Поэтому сплавы прочнее чистых металлов.
Многие металлы сами по себе чересчур мягкие, чтобы их можно было использовать, зато их сплавы могут выдерживать большое давление и высокие температуры (см. статью «Тепло и температура«). Сталь — это сплав железа и углерода, неметалла.
Добавляя небольшие количества других металлов, можно получить разновидности стали. Ножи и вилки делают из нержавеющей стали — сплава стали, хрома и никеля. Сплавы стали с марганцем чрезвычайно прочны и используются в промышленности для изготовления режущих инструментов.
Алюминиево-магниевые сплавы легки, прочны и не подвержены коррозии. Из них делают велосипеды и самолеты (см. статью «Полет«).
Важнейшие металлы и сплавы
Алюминий. Очень легкий серебристо-белый металл, не подверженный коррозии. Его получают из бокситов путем электролиза. Из алюминия делают электропровода, самолеты, корабли (см. статью «Плавучесть«), автомобили, банки для напитков, фольгу для приготовления пищи. Алюминиевые банки для напитков очень легкие и прочные.
Латунь. Ковкий сплав меди и цинка. Из латуни делают украшения, орнаменты, музыкальные инструменты, винты, кнопки для одежды.
Бронза. Известный с древнейших времен ковкий, не подверженный коррозии сплав меди и олова.
Кальций. Мягкий серебристо-белый металл. Входит в состав известняка и мела, а также костей и зубов животных. Кальций в человеческом организме содержится в костях и зубах. Он используется в производстве цемента и высоко качественной стали.
Хром. Твердый серый металл. Используется в производстве нержавеющей стали. Хромом покрывают металлические изделия в защитных целях и для придания им зеркального блеска.
Медь. Ковкий красноватый металл. Из меди делают электропровода, резервуары для горячей воды. Медь входит в состав латуни, бронзы, мельхиора.
Мельхиор. Сплав меди и никеля. Из него делают почти все «серебряные» монеты.
Золото. Мягкий неактивный ярко-желтый металл. Используется в электронике и в ювелирном деле.
Железо. Ковкий серебристо-белый ферромагнетик. Добывается в основном из руды в доменных печах. Используется в инженерных конструкциях, а также в производстве стали и сплавов. В нашей крови тоже есть железо.
Свинец. Тяжелый ковкий ядовитый синевато-белый металл. Добывается из минерала галенита. Из свинца делают электрические батареи, крыши и экраны, защищающие от рентгеновских лучей.
Магний. Легкий серебристо-белый металл. Горит ярко-белым пламенем. Используется для сигнальных огней и фейерверков. Входит в состав легких сплавов. В праздничных ракетах есть магнии и другие металлы.
Ртуть. Тяжелый серебристо-белый ядовитый жидкий металл. Используется в термометрах, входит в состав зубной амальгамы и взрывчатых веществ.
Платина. Ковкий серебристо-белый неактивный металл. Используется в качестве катализатора, а также в электронике и в производстве ювелирных изделий. Платина не вступает в реакции. Из нее делают украшения.
Плутоний. Радиоактивный металл. Образуется в ядерных реакторах при бомбардировке урана и используется в производстве ядерного оружия (см. статью «Ядерная энергия и радиоактивность«).
Калий. Легкий серебристый металл. Очень химически активен. Калиевые соединения входят в состав удобрений.
Серебро. Ковкий серовато-белый металл. Хорошо проводит тепло и электричество. Из него делают украшения и столовые приборы. Входит в состав фотоэмульсии (см. статью «Фотография и фотоаппараты«).
Припой. Сплав олова и свинца. Плавится при сравнительно низкой температуре. Используется для спайки проводов в электронике.
Натрий. Мягкий серебристо-белый химически активный металл. Входит в состав поваренной соли. Используется в производстве натриевых ламп и в химической промышленности.
Сталь. Сплав железа с углеродом. Широко применяется в промышленности. Нержавеющая сталь — сплав стали с хромом — не подвержена коррозии и используется в авиакосмической индустрии (см. статью «Ракеты и космические аппараты«).
Олово. Мягкий ковкий серебристо-белый металл. Слоем олова сталь защищают от коррозии. Входит в состав таких сплавов, как бронза и припой.
Титан. Прочный белый ковкий металл, не подверженный коррозии. Из титановых сплавов делают космические аппараты, самолеты, велосипеды.
Вольфрам. Твердый серовато-белый металл. Из него изготавливают нити ламп накаливания и детали электронных приборов. Из стали с Нить вольфрамом делают накаливания режущие инструменты.
Уран. Серебристо-белый радиоактивный металл, источник ядерной энергии. Применяется при создании ядерного оружия.
Ванадий. Твердый ядовитый белый металл. Придает прочность стальным сплавам. Используется как катализатор при производстве серной кислоты.
Цинк. Синевато-белый металл. Добывается из цинковой обманки. Используется для гальванизации железа, производства электробатареек. Входит в состав латуни.
Классификация и виды металлов
Есть чистые, однокомпонентные структуры и сплавы. Самым классическим примером можно назвать различные виды стали. Они различаются по ГОСТу в соответствии с добавлением легирующих добавок. Чем больше содержание углерода, тем крепче материал. Также есть общепринятое разграничение, ниже представим подтипы.
Черные
Их добывают из металлической руды. В производстве они занимают 90% от всего сырья. Обычно это чугуны и стали. Для изменения характеристик добавляют большее или меньшее количество углерода и легирующие добавки: медь, кремний, хром, никель. Одним из очень популярных подвидов является нержавейка, которая отличается своим блеском поверхности и уникальными свойствами – легкостью, высокой прочностью и устойчивостью к влажности, температурным перепадам.
Что относится к цветным металлам
Второе название – нежелезные, то есть сплавы не содержат в себе железа, а состоят из более дорогостоящих материалов. Вещества имеют различный цвет, отличаются уникальными качествами:
- долговечность;
- длительное сохранение свойств;
- образование оксидной пленки, которая препятствует коррозии.
Благодаря этому, определенные разновидности можно использовать в медицине, ювелирном деле, химической промышленности, при изготовлении электрических проводов. К цветмету относится алюминий, цинк, олово, свинец, никель, хром, серебро, золото и другие.
Медь и ее сплавы являются популярными металлами
Медная руда была обработана человеком одна из первой, потому что она подвергается холодному методу ковки и штамповки. Податливость привела к востребованности повсеместно. Кислород в составе приводит к красному отливу. Но уменьшение валентности в различных соединениях приведет к желтому, зеленому, синему цвету. Привлекательным качеством считается отличная теплопроводность – на втором месте после серебра, поэтому она применяется для проводов. Соединения могут быть:
- твердыми – в сочетании с железом, мышьяком, цинком, фосфором;
- с плохой растворимостью с висмутом, свинцом;
- хрупкими – с серой или кислородом.
К металлам относятся алюминий и сплавы
Al открыт в 1825 году и отличается легкостью и простотой в металлообработке. Производится из бокситов, при этом запасы этой горной породы практически неиссякаемы. Далее элемент соединяют в различных пропорциях с медью, марганцем, магнием, цинком, кремнием. Реже с титаном, литием, бериллием. Особенности в зависимости от добавок:
- хорошая свариваемость;
- устойчивость к коррозии;
- высокая усталостная прочность;
- пластичность.
Его применяют для изготовления ювелирных изделий, столовых приборов, а также для стекловарения, в пищевой и военной промышленности, для создания ракет и для производства водорода и тепла в алюмоэнергетике.
Все о металлах магний, титан и их сплавах
Mg – самое легкое вещество из этой группы. Не обладает прочностью, но есть достоинства, например, пластичность, химическая активность. Благодаря высокой конструкционной способности его добавляют в составы, чтобы увеличивать свариваемость, простоту металлообработки режущим ножом. Необходимо учитывать, что магний очень восприимчив к ржавлению. Титан имеет похожие качества – легкость, пластичность, серебристый цвет. Но антикоррозийная пленка появляется при первом соприкосновении с кислородом. Отличительные особенности – низкая теплопроводность, электропроводность, отсутствие магнитизма. Металл, содержащий титан, – это вещество, используемое для авиационной, химической, судостроительной промышленности.
Антифрикционные сплавы
Характерная особенность этой группы – удобство применения при механических воздействиях. Они практически не создают трения, а также снижают его у других композитов. Очень часто они выступают в качестве твердой смазки для узлов, например, для подшипников. В составе обычно бывает фторопласт, латунь, бронза, железографит и баббит.
Мягкие
Это те, у которых ослаблены металлические связи. По этой причине они имеют более низкую температуру плавления и кипения, просто деформируются. Иногда можно одним нажатием пальца сделать вмятину, ногтем оставить царапину К ним относятся: медь, серебро, золото, бронза, свинец, алюминий, цезий, натрий, калий, рубидий и другие. Одним из наиболее мягких является ртуть, она находится в природе в жидком состоянии.
Что значит твердый металл
В природе такая руда встречается крайне редко. Порода находится у упавших метеоритов. Один из наиболее популярных – хром. Он тугоплавкий и легко поддается металлообработке. Еще один элемент – вольфрам. Он очень плохо плавится, но при правильной обработке используется в осветительных приборах благодаря устойчивости к теплу и гибкости.
Металлические материалы в энергетике
Мы бы не имели такую развитую электросеть и массу приборов, потребляющих электричество, если бы ряд веществ не отличались наличием свободных электронов, положительных ионов и высокой проводимостью. Провода делают из свинца, меди и алюминия. Отлично бы подошло серебро, но его редкость влияет на стоимость, поэтому редко используется.
Особенности черных вторичных металлов
Это отходы, которые образуются в результате одного из этапа металлообработки – ковки, резки. Это могут быть обрезки или стружки. Они отправляются в сталеплавильные печи, но перед этим должны пройти проверки по ГОСТу. Лом называют чермет, его различают на стальной и чугунный по цене. Его использование очень востребовано вместо обработки руды.
Щелочноземельные сплавы
Это твердые вещества, которые имеют высокую химическую активность. В чистом виде встречаются очень редко, зато применяются в соединениях. Их значение нельзя переоценить с точки зрения анатомии человека и животного. Магний и кальций – необходимые микроэлементы.
Понятие щелочной металл
Они способны растворяться в воде, образуя щелочь. Из-за своей повышенной химической активности (вступление в реакцию происходит с бурным действием, воспламенением, выделением газа, дыма) в природе почти не встречается. Ведь на внешнем уровне всего один электрон, который легко отдается любому веществу. Гидроксиды очень важны в промышленности.
Общая характеристика материалов из d- и f-семейств
Это переходные элементы, которые могут являться как окислителями, так и восстановителями. Свойства зависят от среды, в которой они находятся. Но есть и общие:
- на внешнем уровне много электронов;
- несколько степеней окисления;
- увеличенная валентность;
- прочность;
- тягучесть;
- ковкость.
Из чего состоят побочные подгруппы металлов системы Менделеева
По сути это разновидности предыдущей категории – переходные элементы. Это линейка от скандия до цинка. Они часто выплавляются и обладают фактически такими же характеристиками, как и вышеперечисленные материалы из d- и f-семейств.
Существуют ли абсолютно чистые металлы — Справочник металлиста
Материал из Dwarf Fortress Wiki
Полезная производственная схема получения различных металлов и сплавов из руды.
Металл
— это материал, получаемый при переплавке руды в плавильне, что превращает эту руду в слитки чистого металла (один особый металл переплавляется в пластины взамен слитков).
Некоторые металлы можно комбинировать с другими для получения сплавов
с лучшими характеристиками или большей ценностью.
Металлы используются дварфами для ковки оружия, доспехов, мебели и поделок в кузнице.
Переплавка руды в слитки повышает базовую ценность с 3 до 5. Базовая ценность умножается на ценность материала для получения итоговой ценности слитка.
Сплавы[править]
В Dwarf Fortress существует 11 чистых металлов (плюс двенадцатый особый металл). Комбинирование их слитков или исходных руд дополнительно даёт ещё 14 видов сплавов.
Некоторые сплавы ценнее своих начальных компонентов, некоторые изготавливаются специально для повышения характеристик будущего оружия или доспехов, хотя многие сплавы не приносят ни увеличения характеристик, ни повышения уровня богатства (изменения ценности сплавов приводятся в соответствующей колонке в таблице ниже).
Основные причины использования сплавов:
- увеличение боевых характеристик оружия и брони;
- увеличение ценности и экономия редких компонентов (например, использование серебросодержащей руды вместо чистого серебра);
- получение материалов другого цвета (например, rose gold имеет пурпурный оттенок) для мебели, отделки комнат, обозначения рычагов или создания мозаик на полу.
- экономия топлива, например, при выплавке бронзы: за один шаг производства в плавильне тратится единица топлива, а на выходе получается число слитков по количеству использованных компонентов.
Количество слитков нового сплава всегда равно количеству использованных слитков компонентов; в то же время, при выплавке металла из каждой единицы руды получается по четыре слитка.
Полную цепочку производства можно посмотреть в статье о плавлении.
Чистые металлы[править]
Название металлаЦветтайлаИспользуемая руда или реакцияПлотностьТочка плавленияЦенностьматериалаИзменение ценностиПримечания
| Алюминий | ≡‼7:7:1 | Native aluminum | 2.70 | 11188°U | 40 | +0 | |
| Висмут | ≡‼5:5:1 | Bismuthinite | 9.78 | 10488°U | 2 | +1 | Только производство висмутовой бронзы |
| Медь | ≡‼6:4:0 | Native copper, Malachite, Tetrahedrite | 8.93 | 11952°U | 2 | +0, +0, -1* | Ковка любого оружия, доспехов, амуниции и кирок |
| Золото | ≡‼6:6:1 | Native gold | 19.32 | 11915°U | 30 | +0 | |
| Железо | ≡‼0:7:1 | Hematite, Limonite, Magnetite | 7.85 | 12768°U | 10 | +2 | Ковка любого оружия, доспехов, амуниции, кирок и наковален |
| Свинец | ≡‼0:7:1 | Galena | 11.34 | 10589°U | 2 | -3* | |
| Никель | ≡‼7:3:0 | Garnierite | 8.80 | 12619°U | 2 | +0 | |
| Платина | ≡‼7:7:1 | Native platinum | 21.40 | 13182°U | 40 | +0 | |
| Серебро | ≡‼7:7:1 | Native silver, Horn silver,Galena (50%), Tetrahedrite (20%) | 10.49 | 11731°U | 10 | +0, +0,+5*, +7* | Ковка холодного оружия и боеприпасов |
| Олово | ≡‼7:3:0 | Cassiterite | 7.28 | 10417°U | 2 | +0 | |
| Цинк | ≡‼7:3:0 | Sphalerite | 7.13 | 10755°U | 2 | +0 |
Особые металлы[править]
| Эта статья содержит небольшой спойлер ! Возможно, вам лучше не читать эту информацию. |
Название металлаЦветтайлаИспользуемая руда или реакцияПлотностьТочка плавленияЦенностьматериалаИзменение ценностиПримечания
| Адамантин | ≡‼3:3:1 | Raw adamantine | 0.200 | 25000°U | 300 | +50 |
|
| Божественный металл | ≡‼0:0:1 | none | 1 | Нет | 300 |
|
Как отличить медь от других металлов
У большинства из нас знания о меди и ее свойствах ограничиваются школьным курсом химии, что на бытовом уровне вполне достаточно.
Однако иногда возникает необходимость достоверно определить, является ли материал чистым элементом, сплавом или даже композитным материалом.
Мнение, что эта информация нужна лишь тем, кто занимается приемом или сдачей металлолома, ошибочно: к примеру, на форумах радиолюбителей и очень часто поднимаются темы, как отличить медь в проводах от омедненного алюминия.
Коротко об элементе №29
Чистая медь (Cu) – золотисто-розовый металл, обладающий высокой пластичностью, тепло- и электропроводностью. Химическую инертность в обычной неагрессивной среде обеспечивает тончайшая оксидная пленка, которая придает металлу интенсивный красноватый оттенок.
Главное отличие меди от других металлов – окраска
. На самом деле окрашенных металлов не так много: внешне похожи лишь золото, цезий и осмий, а все элементы, входящие в группу цветных металлов (железо, олово, свинец, алюминий, цинк, магний и никель) обладают серым цветом с различной интенсивностью блеска.
Абсолютную гарантию химического состава любого материала можно получить лишь с помощью спектрального анализа. Оборудование для его проведения очень дорогое, и даже многие экспертные лаборатории могут о нем лишь мечтать. Однако, существует немало способов, как отличить медь в домашних условиях
с высокой долей вероятности.
Определение по цвету
Итак, перед нами кусок неизвестного материала, который необходимо идентифицировать как медь. Упор на термин «материал», а не «металл», сделан специально, так как в последнее время появилось немало композитов, которые по внешним признакам и тактильным ощущениям очень похожи на металлы.
В первую очередь рассматриваем цвет. Это желательно делать при дневном свете или «теплом» светодиодном освещении (под «холодными» светодиодами красноватый оттенок меняется на желто-зеленый). Идеально, если для сравнения есть медная пластинка или проволока – в этом случае ошибка в цветовосприятии практически исключена.
Важно: старые медные изделия могут быть покрыты окислившимся слоем (зеленовато-голубым рыхлым налетом): в этом случае цвет металла нужно смотреть на срезе или спиле.
Определение магнитом
Совпадение по цвету – достоверный, но не достаточный способ идентификации. Вторым шагом самостоятельных экспериментов будет проба с магнитом. Химически чистая медь относится к диамагнетикам – т.е. к веществам, не реагирующим на магнитное воздействие.
Если исследуемый материал притягивается к магниту, то это – сплав, в котором содержание основного вещества не более 50%.
Однако, даже если образец не среагировал на магнит, радоваться рано, поскольку нередко под медным покрытием спрятана алюминиевая основа, которая тоже не магнитится (исключить подобное можно с помощью надпиливания или среза).
Определение по реакции на пламя
Еще один способ распознать медь – раскалить образец на открытом огне (газовая плита, зажигалка или обычная спичка). Медная проволока при накаливании сначала потеряет блеск, а затем окрасится в черно-бурый цвет, покрывшись оксидом. Этим способом можно отсечь и композитные материалы, которые при накаливании начинают дымить с образованием газа с резким запахом.
Определение посредством химических экспериментов
Показательной является реакция с концентрированной азотной кислоты: если последнюю капнуть на поверхность медного изделия, произойдет окрашивание в зелено-голубой цвет.
Качественной реакцией на медь является растворение в соляной кислоте с последующим воздействием аммиаком. Если медный образец оставить в растворе HCl до полного или частичного растворения, а потом капнуть туда обычный аптечный нашатырный спирт, раствор окрасится в интенсивно синий цвет.
Важно: работа с химическими реактивами требует соблюдения мер предосторожности. Самостоятельные эксперименты нужно проводить в хорошо проветриваемом помещении с применением средств индивидуальной защиты (резиновые перчатки, фартук, очки).
Как различить медь и сплавы на ее основе?
В промышленности широко распространены медные сплавы.
За многие годы исследований удалось получить немало материалов с уникальными свойствами: высокой пластичностью, электропроводностью, химической стойкостью, прочностью (все зависит от легирующих добавок).
Самыми распространенными являются бронзы (с добавкой олова, алюминия, кремния, марганца, свинца и бериллия), латуни (с добавлением 10-45% цинка), а также медно-никелевые сплавы (нейзильбер, мельхиор, копель, манганин).
Сравнение свойств
Вторая часть элементов в периодической системой отличается многообразием характеристик, поэтому почти невозможно привести полную сводную таблицу. Мы предлагаем таблицу, на которой представлено 4 отличительные черты:
| Признаки | Металлы | Неметаллы |
| Положение в П. С. | Под диагональю бор-астат | Над ней |
| Строение атома | Большой атомный радиус, чисто электронов на последнем слое — от 1 до 3 | Маленький, от 4 до 7 — соответственно |
| Физические св-ва | Электропроводность, теплопроводность, блеск, ковкость, пластичность, по агрегатному состоянию, в основном, твёрдые | Диэлектрики, неблестящие, хрупкие, газы, жидкости и летучие твёрдые вещества |
| Кристаллические решетки | Металлическая | Молекулярная, атомная |
| Химические св-ва | Восстановители | Окислительные (иногда восстанов-ли) |
Мы рассказали про металл, что это за материал, как он используется. Если вам нужны станки по металлообработке, закажите их в . У нас в наличии и на заказ имеются ручные и полуавтоматические ленточнопильные станки, а также маятниковые, вертикальные и двухстоечные агрегаты. Цена на товары снижена в 1.5 — 2 раза по сравнению с зарубежными аналогами. Чтобы уточнить интересующую вас информацию, свяжитесь с менеджерами, мы с радостью поможем в выборе оборудования.
Употребление слова МЕТАЛЛ
Начнем с существительного. Слово МЕТАЛЛ – с двумя ЛЛ – это существительное второго склонения. И означает оно несколько веществ из химической таблицы Менделеева, объединенных сходными свойствами: блеском, плавкостью, электропроводимостью и так далее.
Происходит слово МЕТАЛЛ, согласно словарю Фасмера, из древнегреческого μέταλλον (читается «металлон»), что в буквальном смысле означает «рудник, шахта». В свою очередь, это слово заимствовали римляне, и оно превратилось в латинское metallum. Следом в очереди – французы, называвшие его métal, потом – немцы (Меtаll). А уже Петр I принес это слово в Россию, где оно трансформировалось в привычный нам МЕТАЛЛ.
Все производные от этого существительного слова также имеют корень «-металл-» и пишутся с двумя ЛЛ, независимо от того, к какой части речи принадлежат:
Металлург (сущ.), металлический (прил.), металлолом (сущ.)
Пожалуй, единственный случай, когда это слово имеет лексическое значение химического элемента, но пишется с одной Л – это музыкальный жанр «хеви-метал»: одно из ответвлений «тяжелого» рока. Но и то одна Л обусловлена тем, что «хеви-метал» происходит от английского написания слова: «metal», сохранившимся в русской транслитерации.
Примеры предложений
- Металлические поверхности сильно нагреваются на солнце.
- В городе шумно отпраздновали День металлурга.
- Два раза в год все старшие классы отправлялись на сбор металлолома.
- — Металл металлу рознь, — заявил дед. – Одни притягивают магниты, другие нет.
- — Как надоел ваш хеви-метал! – вздохнула тетя Лена.
- Груда неиспользованного металла росла и грозила заползти в сарай.
- Металлический блеск ткани создавал ощущение холода и заставлял ежиться.
Свойства
Свойства элемента известны ученым давно. По сравнению с другими щелочными металлами он имеют ряд уникальных особенностей, по которым определяются основные сферы применения этого вещества.
Химические
Свойства:
- молярная масса — 6,941;
- валентность — 1;
- электроотрицательность — 1;
- атомный номер — 3;
- ковалентный радиус — 1,23 А;
- теплоемкость — 3,307 кДж/(кг·°С).
Литий проявляет стабильность находясь на воздухе. Из группы щелочных металлов он наименее активный. Про взаимодействии с сухим воздухом и кислородом практические не реагирует (при условии соблюдения комнатной температуры).
Взаимодействие лития с водой проходит относительно спокойно. При контакте с водой он начинает образовывать щелочь, выделять кислород. Металл плавает на поверхности жидкости, быстро растворяясь и издавая характерное шипение.
При влажном воздухе металл вступает в реакции с газами, которые содержатся в нем (особенно с азотом). Оксидная пленка покрывает поверхности лития при нагревании до 100–300°C. Пленка защищает металл от окислительных процессов.
При реакции с серой образуется сульфид (при условии нагревания до 130°C). С кремнием вступает в реакцию при нагревании до 700°C. Растворяется в жидком аммиаке, образуя раствор синего цвета.
Литий нельзя хранить в керосиновой жидкости. Из-за малой плотности материал всплывет на поверхность. Для хранения подойдет минеральное масло, газолин, парафин. Емкость лучше выбирать из жести. Она должна герметично закрываться.
Сера
Физические
Свойства:
- Плотность — 539 кг/м3 (при условии, что температура окружающей среды не превышает 20°C).
- Теплопроводность — 70,8 Вт/(м•К).
- Электрическое сопротивление — 9,29•10-8.
- Линейное расширение — 5,6•10-5 К-1.
- Температура плавления — 180,5°C.
- Предел прочности на растяжение — 116 Мпа.
- Температура кипения — 1340°C.
Показатель относительного удлинения — 70%.
Литий — мягкий, пластичный металл. Проще всего обрабатывается с помощью прокатки, прессования.
Химические свойства и методы получения
В длинной форме периодич. системы химич. элементов граница между элементами-М. и элементами-неметаллами проводится по диагонали от B до At: М. расположены слева от этой линии (к М. относятся ок. 90 известных химич. элементов, точнее – все элементы за исключением $\ce{H, B, C, Si, N, P, As, O, S, Se, Te,}$ галогенов и благородных газов). По строению атома М. подразделяются на непереходные и переходные; среди непереходных М. выделяют щелочные и щёлочноземельные, среди переходных – $d$- и $f$-М., а также редкоземельные, платиновые, трансурановые и др. М. (см. в ст. Химические элементы).
Для атомов М. характерны более низкие значения энергии ионизации, чем для атомов неметаллов. В изменении значений энергии ионизации атомов М. при увеличении их порядкового номера явно выражена периодичность: в общем, при увеличении порядкового номера в пределах отд. периода энергии ионизации М. возрастают, при увеличении порядкового номера в пределах отд. группы – убывают; отклонения от этой тенденции обусловлены строением электронных оболочек атомов (подробнее см. в ст. Периодическая система химических элементов).
Слабой связью валентных электронов с ядром атома объясняются мн. свойства М., проявляющиеся в химич. процессах: образование положительно заряженных ионов (катионов), образование осно́вных оксидов и гидроксидов с осно́вными свойствами (оснований), замещение водорода в кислотах и т. д. В химич. реакциях М. выступают как доноры электронов (восстановители); в кристаллах химич. соединений с др. элементами, а также в водных растворах соединений образуют в осн. элементарные катионы (в растворах – аквакатионы). М. могут входить в состав сложных анионов, напр. перманганат-анион $\ce{MnO_4^-}$, в т. ч. комплексных, напр. ацидокомплекс $\ce{[Fe(CN)_6]^{4–}}$. В сложных ионах и полярных молекулах атомы М. являются центрами положительного заряда. Способность образовывать отрицательно заряженные элементарные ионы для М. нехарактерна (тем не менее формально отрицательные степени окисления М. встречаются в целом ряде комплексных соединений).
Наиболее распространённая химич. реакция, свойственная всем М., – окисление. Способность М. к окислению меняется в очень широких пределах. Мн. М. окисляются кислородом воздуха уже при комнатной темп-ре, однако скорость и механизм реакции очень сильно зависят от природы М. Большинство М. при взаимодействии с кислородом образуют оксиды, щелочные (кроме $\ce{Li}$) и щёлочноземельные М. – также пepоксиды и надпероксиды. Окисление приводит к формированию на поверхности компактного М. плёнки оксида. Такие плёнки, как правило, имеют рыхлую структуру, и их образование не защищает М. от дальнейшего окисления. Очень плотные плёнки, предохраняющие М. от дальнейшего окисления, характерны, напр., для $\ce{Al, Ti, Сr,}$ которые устойчивы на воздухе, хотя и обладают высокой химич. активностью. Крайне неустойчивы на воздухе щелочные М. С азотом ряд М. (напр., $\ce{Li}$) реагируют при комнатной темп-ре, другие М. (напр., $\ce{Mg, Zr, Hf, Ti}$) – при нагревании; при этом образуются нитриды. Мн. М. активно взаимодействуют с водородом (образуются гидриды), галогенами (галогениды), серой (сульфиды), фосфором (фосфиды), др. неметаллами. Наиболее активные М. реагируют с углеродом, образуя карбиды и ацетилениды. В результате металлирования органич. молекул образуются металлоорганические соединения. При сплавлении М. друг с другом – твёрдые растворы или интерметаллиды.
М., имеющие переменную валентность (напр., $\ce{Cr, Mn, Fe}$), в соединениях, отвечающих низшим степеням окисления ($\ce{Cr^{2+}, Mn^{2+}, Fe^{2+}}$), проявляют восстановит. свойства; в высших степенях окисления те же М. ($\ce{Cr^{6+}, Mn^{7+}, Fe^{3+}}$) обнаруживают окислит. свойства. Для водных растворов и растворов электролитов окислительно-восстановит. свойства М. выражают с помощью электрохимич. ряда напряжений (см. в ст. Электродный потенциал). М., для которых стандартные электродные потенциалы меньше, чем –0,413 В, окисляются водой с выделением $\ce{H_2}$ (щелочные и щёлочноземельные М. реагируют с водой при комнатной темп-ре; такие М., как $\ce{Zn}$ или $\ce{Fe}$, реагируют с водяным паром при высоких температурах). С растворами щелочей взаимодействуют М., образующие растворимые анионные гидроксокомплексы ($\ce{Be, Zn, Al, Ga, Sn}$). Большинство М. окисляются теми или иными кислотами. М., стоящие в электрохимич. ряду напряжений до водорода, окисляются ионами $\ce{H^+}$ и поэтому растворяются при действии неокисляющих кислот ($\ce{HCl}$ или разбавленной $\ce{H_2SO_4}$), но только если не образуются нерастворимые продукты; реакции способствует образование анионных комплексов. Азотная кислота, даже разбавленная, окисляет многие М. При этом, если ионы М. устойчивы в низших степенях окисления, образуются катионные комплексы, если в высших, как в случае, напр., $\ce{Re}$, – анионные ($\ce{ReO_4^-}$). Некоторые М. реагируют с разбавленными $\ce{HNO_3}$ и $\ce{H_2SO_4}$ с образованием катионных комплексов и пассивируются в концентриров. растворах этих кислот. Для растворения малоактивных М., напр. $\ce{Au}$ или $\ce{Pt}$, используют смеси, содержащие окислитель и донор лигандов, необходимый для образования растворимых комплексов (напр., смеси $\ce{HNO_3}$ с $\ce{HCl}$ или $\ce{HNO_3}$ с $\ce{HF}$).
Важная характеристика М. – их способность образовывать осно́вные оксиды и соответствующие гидроксиды, а также соли – продукты замещения в кислотах протона на ион М. На примере гидроксидов М. можно проследить закономерности изменения свойств соединений в зависимости от изменения металлич. характера элемента; в частности, наиболее типичные М. – щелочные – образуют наиболее сильные основания (см. в ст. Щёлочи). О взаимодействии М. со средой, ведущей к их разрушению, см. в ст. Коррозия.
Для получения М. практич. значение имеют неск. осн. методов: восстановление оксидов М. углеродом или водородом; восстановление оксидов М. другими М. (металлотермия); восстановление галогенидов или сульфидов М. водородом или металлами; термич. разложение подходящих соединений М. (напр., карбонилов); электрохимич. методы. Поскольку достижению требуемых эксплуатац. характеристик мешает присутствие в М. примесей, используются разл. методы очистки М. (зонная плавка, экстракционные методы и т. д.).
Подробнее о свойствах, методах получения и очистки М. можно узнать в статьях, посвящённых отд. М. или их группам. См. также Металловедение, Металлургия.
Промышленное получение
Для получения лития промышленными способами сначала происходит подготовка расходного сырья — минералов или солевых растворов, которые добываются из соляных озер. Независимо от способа добычи расходного сырья, на выходе получается Li2CO3, который будет проходить промышленную обработку.
Способы получения расходного сырья:
- электролиз;
- восстановление;
- рафинирование.
Выбор промышленного способа получения щелочного металла зависит от наличия оборудования, требуемого результата, вида расходного сырья.
Рафинирование
Металлическое состояние
M. можно представить как вещества, состоящие из положит. ионов и свободных электронов (электронов проводимости). Электроны компенсируют силы отталкивания, действующие между положительно заряженными ионами, и тем самым способствуют связыванию их в твёрдое тело или жидкость (металлическая связь, см. в ст. Химическая связь). Электроны проводимости определяют электрич., магнитные, оптич. свойства М., а также их теплопроводность, а при низких темп-pax – теплоёмкость. Значительна роль электронов в сжимаемости M. и др. механич. свойствах; их наличие делает M. пластичными. Изменение электронного спектра иногда служит причиной фазовых переходов в M., при которых изменение кристаллич. структуры носит вторичный характер (напр., переход из нормального состояния M. в сверхпроводящее или из парамагнитного в ферро- или антиферромагнитное).
Важнейшая характеристика металлич. состояния – число электронов проводимости $n$ в 1 см3 (или их число на элементарную ячейку кристалла либо на 1 атом). Как правило, из всех электронов атома коллективизируются только валентные. Это даёт возможность по химич. свойствам атомов, из которых состоит кристалл, и по его геометрич. структуре определить $n=Z/V_0$, где $Z$ – число валентных электронов, $V_0$ – объём элементарной ячейки.
Mн. свойства M. можно объяснить, считая, что электроны проводимости – идеальный вырожденный газ фермионов, а роль ионов сводится к созданию потенциальной ямы, в которой движутся электроны (модель Друде – Лоренца – Зоммерфельда; см. Друде теория, Зоммерфельда теория). В этой модели темп-pa вырождения $T_\text F$ электронного газа порядка 104–105 К, т. е. практически при любой темп-ре существования М. электронный газ в нём вырожден (см. Вырожденный газ).
Более полное объяснение свойств M. даёт зонная теория твёрдого тела, которая рассматривает движение отд. электрона в периодич. поле с потенциалом $U{\bf (r)}$, создаваемом ионами кристаллич. решётки и остальными электронами (одноэлектронное приближение): $U({\bf r}+a)=U{\bf (r)}$, где ${\bf {r}}$ – пространственная координата точки, $a$ – период решётки (см. Блоховские электроны).
Периодичность U(r) позволяет характеризовать стационарное состояние электрона проводимости квазиимпульсом ${\bf p}=ℏ{\bf k}$ ($ℏ$ – постоянная Планка, ${\bf k}$ – квазиволновой вектор), аналогичным импульсу частицы в свободном пространстве. Волновая функция электрона в стационарном состоянии – решение Шрёдингера уравнения для электрона, отвечающее собств. значению энергии электрона $ℰ_s$. Волновая функция и собств. значение энергии (в отличие от случая свободного электрона) – периодич. функции квазиимпульса. Индекс $s$, нумерующий решения уравнения Шрёдингера, называют номером зоны, $ℰ_s({\bf p})$ – законом дисперсии электронов или электронным спектром кристалла, соответствующим полю. В каждой разрешённой энергетич. зоне состояния электронов заполняют полосу между $ℰ_\text{мин}$ и $ℰ_\text{макс}$. Зоны могут перекрываться, но их индивидуальность при этом сохраняется. С помощью законов дисперсии можно рассчитать плотность электронных состояний в энергетич. зоне.
Рис. 1. Схема заполнения энергетических зон металла (а), полуметалла (б) и диэлектрика или полупроводника (в). Жирные линии ограничивают заполненные состояния ℰ(p), тонкие – пустые состояния, штрихова…
Зонный характер спектра и Паули принцип позволяют сформулировать принципиальное отличие M. от диэлектрика. T. к. в каждую зону может «поместиться» не более 2$N$ электронов ($N$ – число атомов в кристалле), то в зависимости от числа электронов, приходящихся на 1 атом, и взаимного расположения зон могут осуществляться два случая: либо в осн. состоянии (при T=0 К) имеются зоны, частично заполненные электронами (рис. 1, а, б), либо есть только целиком заполненные зоны и пустые (рис. 1, в). В первом случае кристалл является M. (рис. 1, б соответствует полуметаллу), во втором – диэлектриком (или полупроводником).
В M. граница заполнения уровней электронами (энергия Ферми $ℰ_F$) попадает в разрешённую зону. Соответствующая ей изоэнергетич. поверхность ℰ({\bf p})=ℰ_F (поверхность Ферми) отделяет область занятых электронами состояний от свободных в импульсном пространстве.
Рис. 2. Поверхности Ферми вольфрама (а) и гадолиния (б).
Поверхности Ферми щелочных М. ($\ce{Li, Na, K, Pb, Cs}$) – почти идеальные сферы. Это не означает, что электроны этих М. не испытывают влияния ионов. Их эффективные массы отличаются от массы свободного электрона $m_0$, напр. у $\ce{Na}$ $m=1,24m_0$. У всех M., кроме перечисленных, поверхности Ферми имеют сложную форму (рис. 2).
Некоторые свойства M. (гл. обр. в сильном магнитном поле) очень чувствительны к форме поверхности Ферми (см. Де Хааза – ван Альвена эффект, Шубникова – де Хааза эффект), что позволило экспериментально определить поверхность Ферми мн. M. и интерметаллич. соединений.
Методы зонной теории позволили определить законы дисперсии, выяснить происхождение отд. характерных деталей электронного спектра M. При всей сложности законов дисперсии представление об электронах M. как лёгких (по сравнению с ионами) заряженных частицах является правильным на качественном уровне и позволяет в рамках модели Друде – Лоренца – Зоммерфельда оценить порядок величин осн. характеристик M. – электронной теплоёмкости, электро- и теплопроводности, толщины скин-слоя (см. Скин-эффект) и т. п. У некоторых соединений ($\ce{CeAl_3, CeCu_6, CeCu_2Si_2, UB_{13}}$ и др.) обнаружены необычные свойства (напр., гигантская электронная теплоёмкость), указывающие на то, что в них есть электроны, обладающие аномально большой эффективной массой.
При высоких давлениях, когда объём, приходящийся на 1 атом, уменьшается, атомы теряют свою индивидуальность и любое вещество превращается в сильно сжатую электронно-ядерную плазму, т. е. в своеобразный M. Металлизация любого вещества происходит при плотности $≫20Z^2$, где $Z$ – атомный номер вещества. При таких плотностях большинство свойств вещества определяется вырожденным электронным газом.
Применение металлов
В технике в осн. применяют сплавы М. Так, напр., из-за малой прочности чистые M. непригодны в качестве материалов для изготовления конструкций, но мн. сплавы M. обладают одновременно высокой механич. прочностью и высокой пластичностью и находят широкое применение в качестве конструкционных материалов. M. с низким уровнем внутр. трения, слабо рассеивающие энергию колебаний, используют при изготовлении акустич. резонаторов муз. инструментов. М. и их сплавы используют: в электротехнике как в качестве проводников электрич. тока (медь, алюминий), так и в качестве материалов для резисторов и электронагреват. элементов (нихром и т. п.); в инструментальной технике для изготовления рабочей части инструментов (в осн. это инструментальные стали и твёрдые сплавы).