Предисловие
Таблица Менделеева или периодическая таблица химических элементов — это представленный в виде таблицы свод химических элементов, которые расположены по возрастанию атомного номера. В каждой ячейке таблицы Менделеева так же есть обозначение элемента, его атомная масса, принадлежность к определенной группе обозначенная цветом, а так же иногда указывается электронная конфигурация. Структура таблицы показывает периодических характер химических свойств элементов. Она имеет 7 строк, которые называются периодами, и столбцы, которые называются группами. Именно столбцы объединяют элементы со схожими химическими свойствами. Например, щелочные металлы, щелочно-земельные металлы, галогениды, благородные газы и т.д. Так же имеется четыре прямоугольные области, которые объединяют элементы со схожим электронным строением их атомов.
На данный момент открыто 118 химических элементов, которые завершили заполнение семи строк таблицы. Первые 94 элемента были найдены в природе, хотя некоторые в очень маленьких количествах, а вот остальные синтезированы искусственно в физических лабораториях или вообще при ядерных взрывах. В настоящее время ученые-физики продолжают попытки синтезировать 119 элемент и более тяжелые, теоретически возможность этих элементов была доказана ранее — они начнут восьмой ряд периодической таблицы Менделеева. Кроме того, все элементы имеют так называемые изотопы, которые так же в большом количестве были синтезированы в лабораториях и обнаружены в природе. Наиболее известный пример — тяжелая вода, где водород с атомным весом 1 заменяет его изотоп дейтерий (вес 2) или тритий (вес 3).
Структура периодической таблицы используется для нахождения взаимосвязи между свойствами различных элементов и их соединений, а так же для прогноза этих свойств в том числе еще не открытых соединений.
Первую известную таблицу Менделеев опубликовал в 1869 году, которая демонстрировала периодический характер свойств известных на тот момент элементов. Так же Менделеев дал предсказания по свойствам не открытых на тот момент элементов и большинство его предсказания оказались близки к верным. В последующем с открытием других элементов расширялись и теоретические знания, стали появляться всё более точные теоретические математические модели для объяснения и предсказания свойств элементов.
Современная таблица Менделеева теперь широко используется для анализа химических реакций и вообще широко используется как в химии так и физике. Однако, много споров ведется относительно того на сколько оптимален тот или иной вид таблицы (их несколько десятков), а так же размещения некоторых элементов.
Новое в блогах
Медь
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век). Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди. У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков производят русское слово медь (польск. miedz, чешск. med) от древненемецкого smida (металл) и Schmied (кузнец, англ. Smith). Конечно, родство корней в данном случае несомненно, однако, оба эти слова произведены от греч. рудник, копь независимо друг от друга. От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь венера (Venus). В более древние времена встречается название марс (Mars).
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет. Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами. Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
Современные способы добычи
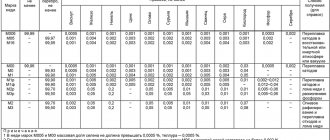
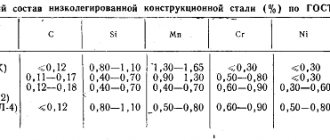
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования. Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди. Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига. После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C. С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине. Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования. Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
https://pikabu.ru/story/interesnyie_faktyi_o_medi_1238185
Интересные факты о меди
Интересные факты о меди.
Интересный факт №1
Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
Интересный факт №2
Медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %
Интересный факт №3
Медь встречается в природе как в соединениях, так и в самородном виде. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо.
Интересный факт №4
Медь является природным антибактериальным средством, и «тормозит» распространение бактерий в воде и воздухе из систем, изготовленных из нее. Таким же образом, латунные дверные ручки и поручни в общественных зданиях могут помочь свести к минимуму риск бактериальной передачи.
Интересный факт №5
Полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Интересный факт №6
В разнообразных областях техники широко используются сплавы с использованием меди, самыми распространёнными являются бронза и латунь
Интересный факт №7
Медь является одним из важнейших участников метаболических процессов в организме человека и входит практически во все органы и ткани, поэтому она привлекает внимание биомедицины. Группой известных лабораторий Ирландии и Франции был разработан состав, который при соприкосновении с кожей активизирует жизненно важные процессы в организме человека. Этим составом обрабатываются нити джинсов Gold Vision – 3000 Classic. Модель была создана знаменитыми французскими кутюрье. Уникальность этих джинсов состоит в «медном поясе», «усиленных» медью карманах и гульфике, а также в использовании медных клепок и пуговиц. Таким образом формируется «медный корсет», который создает условия для улучшения физиологических функций организма.
Интересный факт №8
Инструменты изготовленые из меди или медных сплавов не вызывают искру, и, таким образом, используются везде, где есть опасность взрыва.
Интересный факт №9
Медное покрытие применяется для изготовления скальпеля хирурга и проводит электричество для нагрева лезвия, делая, таким образом, прибор самостоятельного прижигания.
Интересный факт №10
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Интересный факт №11
Многие народы приписывают меди целебные свойства. Непальцы, например, считают медь священным металлом, который способствует сосредоточению мыслей, улучшает пищеварение и лечит желудочно-кишечные заболевания (больным дают пить воду из стакана, в котором лежат несколько медных монет). Один из самых больших и красивых непальских храмов носит название «Медный».
Интересный факт №12
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Интересный факт №13
В организме взрослого человека содержится до 80 мг меди.
Интересный факт №14
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Введение
Каждый химический элемент в таблице Менделеева имеет свой уникальный атомный номер (Z), который равен числу протонов в его атомном ядре. У каждого атома в ядре может быть разное число нейтронов и поэтому атом одного элемента может иметь разную массу — такие «варианты» одного атома отличающиеся по массе называют изотопами. Например, самые распространенные изотопы урана U235 и U238, но на самом деле изотопов известно восемь на данный момент с атомными массам от 233 до 240. Изотопы в таблице не разделяются, в ней указывается самый распространенный природный изотоп или для атомов, которые стабильных изотопов не имеют, указывается наиболее стабильный (долгоживущий).
В общепринятой периодической таблице (см. выше) химические элементы указываются в порядке возрастания атомного номера Z. Новая строка (период) начинается тогда, когда начинает заполняться новая электронная оболочка атома.
Столбцы (группы) определяются электронной конфигурацией атома. Элементы с одинаковым чистом электронов на валентном электронном уровне попадают в одни и те же группы. Элементы находящиеся в одной группе как правило имеют схожие химические свойства.
Первые 94 элемента встречаются в природе в свободном и связанном виде либо только в виде составе соединений, остальные же синтезированы в лабораториях. Некоторые элементы, например, франций (Fr) был зафиксирован только в виде излучения (получено всего 300 тыс. атомов). Другие элементы выше 94 получены так же в очень малых количествах.
Как читать таблицу Дмитрия Ивановича Менделеева
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
В настоящий же момент выделено 18.
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида.
Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
Периоды
Горизонтальные цепочки в таблице, в которых элементы расположены по росту порядкового номера. В линии слева направо увеличиваются заряды ядра атомов.
Периодов всего 7:
- 1-й период содержит лишь гелий He2 и водород H1;
- 2 и 3 содержат по 8 компонентов;
- 4-й и 5-й содержат 18 единиц каждый;
- 6-й период вмещает 32 элемента;
- 7-й хранит 31 единицу и продолжает дополняться.
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
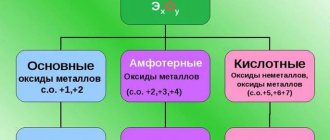
Металлы, металлоиды и неметаллы
По своим физико-химическим свойствам все элементы можно разделить на три основные категории — металлы, металлоиды и неметаллы.
Металлы — это как правило блестящие высоко теплопроводные твёрдые вещества способные плавиться при нагревании и образовывать друг с другом сплавы, а так же образовывать ионные и ковалентные соединения с неметаллами.
Неметаллы — это как правило бесцветные либо цветные твёрдые, жидкие или газообразные вещества. Неметаллые образуют соединения друг с другом при помощи ковалентных связей.
Металлоиды — это вещества, которые могут проявлять в определенных условиях как металлические свойства, так и неметаллические.
Металлы и неметаллы могут быть дополнительно классифицированы на подкатегории, которые видны в таблице в строках слева направо. Так металлы подразделяются на химически очень активные щелочные металлы, чуть менее активные щелочно-земельные, характерные переходные металлы и химически достаточно инертные постпереходные металлы.
Неметаллы подразделяются на многоатомные неметаллы, при этом они ближе к металлоидам т.к. иногда проявляют металлические свойства, на галогениды и инертные газы. Доля неметаллов среди всех элементов небольшая — их 19 из 118 известных элементов.
На самом же деле такое подразделение даже внутри каждой категории весьма условно и на этих условных границах есть большое «перекрытие». Например, бериллий относится к щелочно-земельным элементам, но его амфотерность и склонность образовывать ковалентные соединения позволяют относить его к постпереходным металлам. Радон относится к благородным газам, но образует ряд ионных соединений характерных для металлов. Поэтому существуют и другие типы разделения элементов на группы, например, по минералогическим признакам или кристаллическим структурам соединений.
Периодическая таблица Менделеева
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
Интересно знать! Существует легенда, что готовая система привиделась ученому во сне.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды),
- группы – вертикальные строчки, в один ряд.
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
Щелочные и щелочно-земельные металлы
Эти две категории очень похожи друг на друга, но щелочно-земельные металлы менее химически активны. Все они образуют основные оксиды. Для них характерна низкая механическая прочность, все щелочные металлы легко режутся ножом, очень высокая химическая активность (например, калий, и тем более рубидий могут воспламеняться прямо на воздухе, а с водой реагировать со «взрывом» — реакиция идет настолько быстро, что раздаётся хлопок). Магний и бериллий более твёрдые и гораздо менее реакционно способные, поэтому они используются иногда в чистом виде или в виде сплавов (магний-алюминиевый сплав очень важен в авиационной отрасли, например).
Переходные металлы
У этой группы очень широкий спектр физических и химических свойств. Например, температура плавления у ртути -38,8 ºC, а у иттрия 1795 ºC. Так же в очень широком диапазоне находится твёрдость, плотность, химическая активность (например, благородный металл золото очень химически инертен, а цинк наоборот весьма реакционно способен и по этому показателю ближе к щелочно-земельным элементам). Металлы этой группы — основа всех промышленных производств и сфер жизни. Они применяются во всех отраслях промышленности — от конструкционных материалов до микроэлектронной промышленности.
Неметаллы (реакционные)
При нормальных условиях бор, углерод, фосфор, сера, селен — твёрдые вещества различных цветов. Каждое их них имеет различные формы кристаллической решетки (аллотропные модификации), например красный, желтый, черный, белый фосфор, которая очень сильно влияет на их химическую активность (например, графит гораздо менее активен обычного угля) и физические свойства (алмаз самое твердое вещество в природе и это прозрачный материал, а графит хрупкий, мягкий, непрозрачный).
Азот и кислород — газы. При этом азот достаточно химически инертен, кислород напротив является очень активным окислителем.
Галогениды имеют разные физические свойства (фтор, хлор — газы, бром — жидкость, иод — твердое вещество). Астат получен только в крайне малых количествах как и теннессин, их свойства изучены плохо. Химически галогениды — очень сильные окислители (фтор самый сильный в Таблице Менделеева). С металлами образуют как правило соли с ионной решеткой, а с водородом очень сильные кислоты. С неметаллами так же образуют множество многоатомных соединений как правило с ковалентными связями.
Неметаллы (инертные газы)
Крайне химически пассивные вещества. Первое соединение ксенона XePtF6 было синтезировано в 1962 году, а соединения неона и гелия до сих пор неизвестны. Тем не менее инертные газы играют огромную роль в различных отраслях промышленности, медицине, при подводных погружениях и т.д.
P.S.: Интересно, что название «Таблица Менделеева» известна в основном только в России, а в остальном мире она называется чаще всего просто «Периодическая таблица».
P.P.S.: Статья будет дополняться и корректироваться.
Периодический Закон Д.И. Менделеева
Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что
«… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра.
Современная формулировка периодического закона
звучит следующим образом
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Преподавая химию, Менделеев понимал, что запоминание индивидуальных свойств каждого элемента, вызывает у студентов трудности. Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица, позже она стала называться периодической.
Наша современная таблица очень похожа на менделеевскую. Рассмотрим ее подробнее.